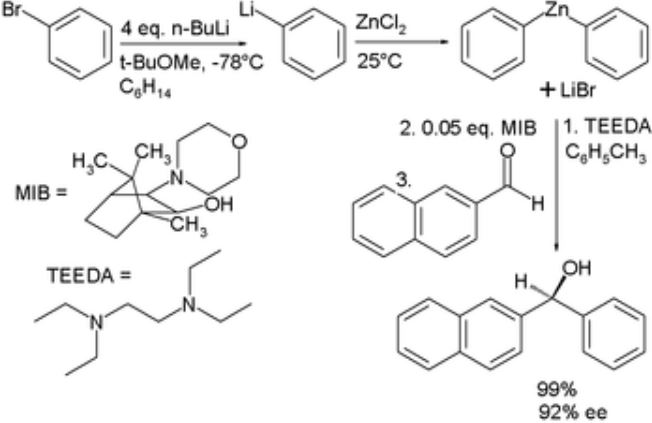
Tổng quan về công thức hóa học của kẽm và các hợp chất quan trọng
Công thức hóa học của kẽm là nền tảng để hiểu về kim loại quan trọng này. Kẽm tham gia vào nhiều phản ứng hóa học đặc trưng với axit và bazơ. Các hợp chất của kẽm có ứng dụng rộng rãi trong công nghiệp mạ điện và y học. Kim loại này còn đóng vai trò thiết yếu trong các quá trình sinh học của cơ thể sống.
Công thức hóa học của kẽm và các hợp chất quan trọng
Kẽm là kim loại có nhiều ứng dụng quan trọng trong đời sống và công nghiệp. Công thức hóa học của kẽm nguyên chất là Zn với số oxi hóa +2 trong hầu hết các hợp chất.
Oxit kẽm (ZnO) là hợp chất phổ biến nhất của kẽm. Đây là chất bột màu trắng, không tan trong nước nhưng tan trong axit và bazơ. Tôi thường giải thích cho học sinh rằng ZnO giống như “bột phấn trắng” có tính lưỡng tính.
Muối kẽm sunfat (ZnSO4) tồn tại ở dạng tinh thể màu trắng. Công thức đầy đủ là ZnSO4.7H2O, trong đó:
- Zn2+ là ion kẽm mang điện tích dương
- SO42- là gốc sunfat mang điện tích âm
- 7H2O là 7 phân tử nước kết tinh
Kẽm clorua (ZnCl2) là muối tan tốt trong nước. Qua nhiều năm giảng dạy, tôi nhận thấy học sinh dễ nhớ công thức này khi liên hệ với muối ăn NaCl – chỉ cần thay Na+ bằng Zn2+.
Kẽm hidroxit Zn(OH)2 có tính chất đặc biệt. Chất này tạo kết tủa trắng khi cho dung dịch bazơ vào dung dịch muối kẽm. Kết tủa này tan được trong cả axit và bazơ dư, thể hiện tính lưỡng tính của kẽm.
Trong phòng thí nghiệm, tôi thường cho học sinh quan sát phản ứng:
Zn + 2HCl → ZnCl2 + H2↑
Phản ứng này sinh ra khí hidro sủi bọt, giúp học sinh dễ nhớ tính chất của kẽm.
Tính chất và phản ứng hóa học cơ bản của kẽm
Kẽm là kim loại có màu trắng xanh, dễ bị oxy hóa trong không khí ẩm. Khi tiếp xúc với không khí, bề mặt kẽm sẽ tạo thành một lớp màng oxit bảo vệ.
Trong tự nhiên, kẽm thường tồn tại dưới dạng hợp chất như công thức nhôm oxit và các muối khoáng. Tương tự như Công thức hóa học của sắt, kẽm có khả năng tham gia nhiều phản ứng hóa học quan trọng.
Kẽm phản ứng với oxi tạo kẽm oxit
Kẽm oxit là gì? Đó là hợp chất tạo thành khi kẽm phản ứng với oxi trong không khí. Phản ứng này xảy ra mạnh khi đun nóng:
2Zn + O2 → 2ZnO
Kẽm oxit là chất bột màu trắng, không tan trong nước nhưng tan được trong axit và bazơ. Trong công nghiệp, ZnO được sử dụng làm chất phụ gia trong cao su và mỹ phẩm.
Phản ứng của kẽm với các axit
Kẽm phản ứng với axit theo phương trình tổng quát:
Zn + 2H+ → Zn2+ + H2
Phản ứng này thường xảy ra mạnh mẽ và tạo khí hydro. Ví dụ với axit HCl:
Zn + 2HCl → ZnCl2 + H2
Trong phòng thí nghiệm, tôi thường cho học sinh quan sát phản ứng này qua thí nghiệm đơn giản: cho mảnh kẽm vào ống nghiệm chứa dung dịch HCl loãng.
Phản ứng của kẽm với bazơ
Kẽm có tính lưỡng tính nên có thể phản ứng với bazơ mạnh như NaOH:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
Phản ứng này tạo thành muối natri tetrahydroxozincat và khí hydro. Đây là một trong những phản ứng quan trọng để nhận biết tính chất của kẽm.

Trong quá trình giảng dạy, tôi thường nhấn mạnh với học sinh rằng phản ứng này chỉ xảy ra với bazơ mạnh và cần có sự có mặt của nước.
Các hợp chất vô cơ quan trọng của kẽm và ứng dụng
Kẽm tạo thành nhiều hợp chất vô cơ có vai trò quan trọng trong công nghiệp và đời sống. Mỗi hợp chất đều có những tính chất và ứng dụng đặc trưng riêng.
Kẽm sunfat và công dụng trong công nghiệp
Công thức kẽm sunfat là ZnSO4, tồn tại dưới dạng tinh thể màu trắng, dễ tan trong nước. Hợp chất này được sử dụng rộng rãi trong ngành dệt may làm chất cố định màu nhuộm.
Trong nông nghiệp, ZnSO4 là thành phần của nhiều loại phân bón vi lượng giúp cây trồng phát triển tốt, tương tự như Công thức hóa học của NPK.
Kẽm clorua và ứng dụng trong mạ điện
Kẽm clorua công thức ZnCl2 là chất rắn màu trắng, có tính hút ẩm mạnh. Trong công nghiệp, ZnCl2 được dùng làm chất điện phân trong quy trình mạ kẽm.
Hợp chất này còn được sử dụng để tẩm gỗ chống mục nát và làm chất xúc tác trong nhiều phản ứng hóa học quan trọng.
Kẽm hidroxit và tính chất đặc trưng
Kẽm hidroxit tính chất nổi bật là tính lưỡng tính, có thể tác dụng với cả axit và bazơ. Zn(OH)2 là chất kết tủa màu trắng, không tan trong nước.
Trong phòng thí nghiệm, tôi thường cho học sinh quan sát phản ứng tạo kết tủa Zn(OH)2 và sự tan của nó trong dung dịch kiềm dư, giúp các em hiểu rõ tính lưỡng tính.
Kẽm nitrat trong sản xuất phân bón
Kẽm nitrat là gì? Đây là muối có công thức Zn(NO3)2, dạng tinh thể không màu và rất dễ tan trong nước. Hợp chất này thường được dùng làm phân bón cung cấp nitơ và kẽm cho cây trồng.
Trong công nghiệp, Zn(NO3)2 còn được sử dụng như chất xúc tác và là nguyên liệu sản xuất phèn nhôm.
Kẽm cacbonat trong y học và mỹ phẩm
Kẽm cacbonat công thức ZnCO3 là hợp chất màu trắng, khó tan trong nước. Trong y học, ZnCO3 được dùng làm thuốc bôi ngoài da trị các bệnh ngoài da.
Trong ngành mỹ phẩm, ZnCO3 là thành phần quan trọng của phấn phủ và kem chống nắng nhờ khả năng che phủ tốt và an toàn cho da.
Các hợp chất đặc biệt của kẽm và vai trò sinh học
Kẽm tạo nên nhiều hợp chất quan trọng trong đời sống và công nghiệp. Công thức hóa học của kẽm trong các hợp chất thường ở dạng ion Zn2+.
Các hợp chất kẽm đóng vai trò thiết yếu trong cơ thể sống. Chúng tham gia vào quá trình tổng hợp protein và tăng cường hệ miễn dịch.
Kẽm có trong nhiều thực phẩm như cơm có chứa chất gì, thịt đỏ và hải sản. Thiếu kẽm có thể gây chậm phát triển ở trẻ em.
Kẽm sunfua trong công nghiệp sơn
Kẽm sunfua tính chất nổi bật là bột màu trắng, không tan trong nước. Công thức hóa học là ZnS.
Trong công nghiệp sơn, ZnS được sử dụng làm chất độn và tạo màu trắng. Nó giúp tăng độ bền và khả năng chống ăn mòn cho sơn.
Tôi thường lấy ví dụ về lớp sơn trắng bóng trên xe hơi để minh họa ứng dụng của ZnS. Học sinh rất thích thú khi biết về vai trò của hợp chất này.
Kẽm photphat và vai trò dinh dưỡng
Kẽm photphat là gì? Đây là muối có công thức Zn3(PO4)2, tồn tại dưới dạng bột trắng.
Trong cơ thể, kẽm photphat tham gia vào quá trình tạo xương và răng. Nó cũng giúp hấp thu canxi tốt hơn.
Qua 20 năm giảng dạy, tôi nhận thấy học sinh dễ nhớ vai trò của hợp chất này khi liên hệ với việc uống sữa bổ sung canxi hàng ngày.
Kẽm axetat trong y học

Kẽm axetat công thức Zn(CH3COO)2 được sử dụng rộng rãi trong ngành dược phẩm.
Hợp chất này thường có trong thuốc bổ sung kẽm và các loại thuốc điều trị bệnh ngoài da. Nó giúp làm lành vết thương nhanh hơn.
Kẽm axetat cũng được dùng trong sản xuất kẹo cao su và thực phẩm chức năng. Tuy nhiên cần kiểm soát liều lượng để đảm bảo an toàn.
FAQ: Câu hỏi thường gặp về kẽm và hợp chất
Kẽm và các hợp chất của nó có nhiều ứng dụng quan trọng trong đời sống. Tôi sẽ giải đáp một số thắc mắc phổ biến về nguyên tố này.
Kẽm có phải là kim loại nặng không?
Kẽm được xếp vào nhóm kim loại nặng với khối lượng riêng 7,14 g/cm3. So với thép là gì có khối lượng riêng khoảng 7,85 g/cm3, kẽm nhẹ hơn một chút.
Tuy nhiên, công thức hóa học của kẽm đơn giản chỉ là Zn nên độc tính của nó thấp hơn nhiều so với các kim loại nặng khác như chì hay thủy ngân.
Tại sao kẽm được sử dụng trong mạ điện?
Kẽm có khả năng chống ăn mòn tuyệt vời nhờ lớp oxit bảo vệ ZnO hình thành trên bề mặt. Giống như vàng là gì trong hóa học, kẽm bền vững trong không khí.
Khi mạ điện, kẽm sẽ tạo một lớp phủ mỏng bám chắc lên bề mặt kim loại cần bảo vệ. Lớp kẽm này đóng vai trò anot hy sinh, bị ăn mòn thay cho kim loại bên trong.
Kẽm có vai trò gì trong cơ thể sống?
Kẽm là nguyên tố vi lượng thiết yếu tham gia vào hơn 300 enzyme trong cơ thể. Nó đóng vai trò quan trọng trong quá trình tổng hợp protein và DNA.
Thiếu kẽm có thể gây chậm phát triển ở trẻ em, suy giảm miễn dịch và rối loạn sinh sản. Nhu cầu kẽm hàng ngày của người trưởng thành là 8-11mg.
Tuy nhiên, dư thừa kẽm cũng có thể gây độc. Liều lượng an toàn tối đa là 40mg/ngày đối với người lớn.
Kiến thức về công thức hóa học của kẽm và các hợp chất của nó đóng vai trò quan trọng trong học tập và ứng dụng thực tiễn. Kẽm tham gia vào nhiều phản ứng hóa học đặc trưng và tạo thành các hợp chất có giá trị trong công nghiệp, y học và đời sống. Các tính chất và phản ứng của kẽm cùng các hợp chất của nó tạo nên nền tảng cho việc nghiên cứu sâu hơn về hóa học vô cơ.
Bài viết liên quan
Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

