Điểm qua công thức hóa học của clo và các hợp chất quan trọng
Công thức hóa học của clo đóng vai trò quan trọng trong ngành công nghiệp và đời sống. Nguyên tố này tồn tại dưới nhiều dạng khác nhau trong tự nhiên. Clo tham gia vào các phản ứng hóa học đặc trưng và tạo thành nhiều hợp chất hữu ích. Các ứng dụng của clo trong xử lý nước và môi trường mang lại nhiều lợi ích thiết thực.
Công thức hóa học của clo và các dạng tồn tại trong tự nhiên
Clo là một nguyên tố hóa học thuộc nhóm halogen với số hiệu nguyên tử 17. Công thức hóa học của clo nguyên tử là Cl, phân tử là Cl2.
Trong tự nhiên, clo trong hóa học tồn tại chủ yếu ở dạng hợp chất với các nguyên tố khác. Dạng phổ biến nhất là muối NaCl trong nước biển và các mỏ muối.
Clo phân tử Cl2 là chất khí màu vàng lục ở điều kiện thường, có mùi hắc đặc trưng. Tôi thường ví von với học sinh rằng màu của khí clo giống như màu của lá cây non vậy.
Trong phòng thí nghiệm, chúng ta có thể điều chế clo bằng phản ứng:
2NaCl + 2H2SO4 + MnO2 → Na2SO4 + MnSO4 + 2H2O + Cl2↑
Clo còn tồn tại ở dạng ion Cl- trong các dung dịch. Ion clorua này đóng vai trò quan trọng trong cơ thể sống. Tôi thường nhắc học sinh nhớ rằng dịch vị trong dạ dày chứa HCl giúp tiêu hóa thức ăn.
Với tính oxi hóa mạnh, clo thường được sử dụng để tẩy trắng và khử trùng. Kinh nghiệm 20 năm giảng dạy cho thấy học sinh dễ nhớ tính chất này khi liên hệ với việc khử trùng nước bể bơi bằng clo.
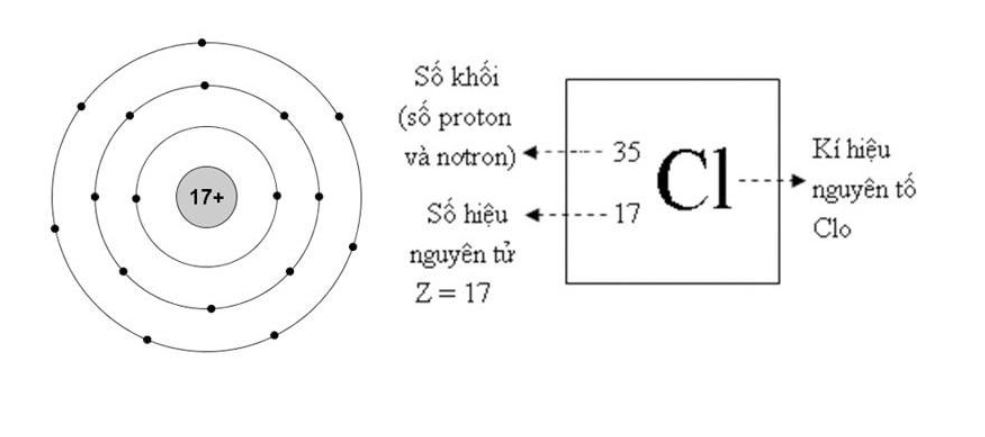
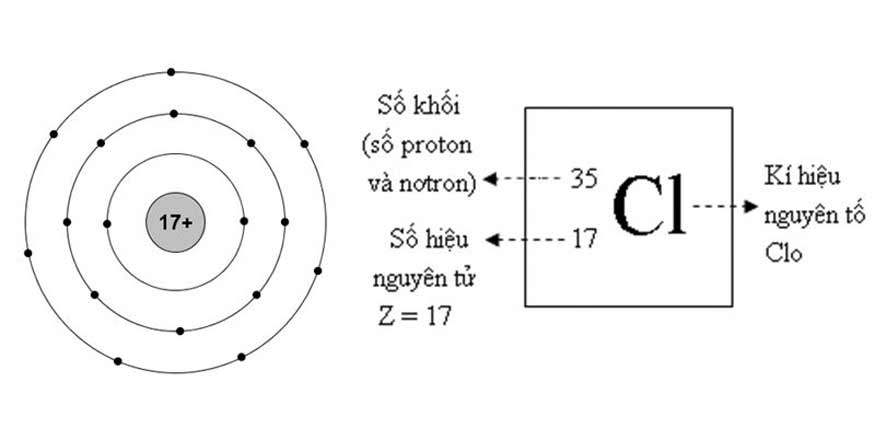
Cấu tạo và đặc điểm của nguyên tử clo trong bảng tuần hoàn
Clo nguyên tử có số hiệu nguyên tử là 17, khối lượng nguyên tử là 35,5. Nó thuộc nhóm VIIA (nhóm halogen) trong bảng tuần hoàn.
Trong tự nhiên, clo tồn tại dưới dạng hai đồng vị chính là 35Cl (chiếm 75,77%) và 37Cl (chiếm 24,23%). Đây là lý do khối lượng nguyên tử trung bình của clo là 35,5.
Clo có khả năng tạo liên kết với nhiều nguyên tố khác nhờ cấu hình electron đặc biệt của nó. Giống như công thức hoá học của oxi, clo rất hoạt động trong phản ứng hóa học.
Cấu hình electron của nguyên tử clo
Cấu hình electron của clo là: 1s2 2s2 2p6 3s2 3p5
Lớp electron ngoài cùng của clo có 7 electron (3s2 3p5). Do thiếu 1 electron để đạt cấu hình bền của khí hiếm nên clo dễ nhận thêm 1 electron.
Trong quá trình giảng dạy, tôi thường ví von lớp electron ngoài cùng như một chiếc bánh bị thiếu một miếng nhỏ. Điều này giúp học sinh dễ nhớ tại sao clo thường nhận thêm electron.
Số oxi hóa của clo trong các hợp chất
Clo có thể tồn tại ở nhiều trạng thái oxi hóa khác nhau, từ -1 đến +7. Số oxi hóa phổ biến nhất là:
-1: trong các hợp chất với kim loại (NaCl, KCl)
+1: trong HClO
+3: trong HClO2
+5: trong HClO3
+7: trong HClO4
Mỗi số oxi hóa tương ứng với một loại hợp chất có tính chất đặc trưng riêng. Điều này tạo nên sự đa dạng trong ứng dụng của clo.
Tính chất hóa học đặc trưng của clo
Tính chất hóa học của clo rất đa dạng và mạnh mẽ. Clo là một chất oxi hóa mạnh, dễ dàng phản ứng với hầu hết kim loại.
Khi hòa tan trong nước, clo tạo ra dung dịch nước clo có tính tẩy màu và khử trùng mạnh. Phản ứng này được biểu diễn:
Cl2 + H2O ⇌ HCl + HClO
Trong công nghiệp, clo được sử dụng rộng rãi để sản xuất nhựa PVC, thuốc tẩy và xử lý nước. Tôi thường nhấn mạnh với sinh viên rằng mọi bể bơi đều cần clo để đảm bảo vệ sinh.
Phân tử Cl2 và các phản ứng hóa học quan trọng
Phân tử Cl2 là một trong những chất quan trọng trong công nghiệp hóa chất. Nó tham gia vào nhiều phản ứng hóa học đặc trưng và có nhiều ứng dụng thiết thực.
Cấu tạo phân tử Cl2
Clo phân tử có cấu tạo gồm 2 nguyên tử clo liên kết với nhau bằng liên kết cộng hóa trị không cực. Mỗi nguyên tử clo có 7 electron hóa trị, chúng dùng chung một cặp electron để tạo liên kết.
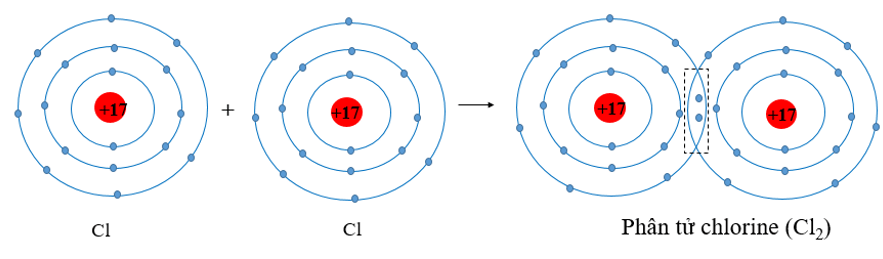
Trong quá trình giảng dạy, tôi thường ví von liên kết trong Cl2 như hai người bạn nắm tay nhau. Điều này giúp học sinh dễ hình dung và nhớ lâu hơn về cấu tạo của phân tử này.
Các phản ứng đặc trưng của phân tử Cl2
Clo phản ứng mạnh với nhiều kim loại tạo thành muối clorua. Phản ứng này tỏa nhiệt và ánh sáng rất mạnh.
Ví dụ phản ứng với natri:
2Na + Cl2 → 2NaCl
Cl2 còn phản ứng với hydro tạo thành HCl. Đây là phản ứng tôi thường dùng để minh họa phản ứng quang hóa cho học sinh:
H2 + Cl2 → 2HCl
Tương tự như công thức hóa học của carbon dioxide, Cl2 cũng tham gia phản ứng với nước tạo dung dịch có tính oxy hóa mạnh.
Ứng dụng của phân tử Cl2 trong công nghiệp
Cl2 được sử dụng rộng rãi trong công nghiệp sản xuất nhựa PVC. Nó là nguyên liệu quan trọng để tổng hợp các hợp chất clo hữu cơ.
Trong xử lý nước, Cl2 đóng vai trò là chất khử trùng hiệu quả. Nó tiêu diệt vi khuẩn và làm sạch nước sinh hoạt.
Ngành công nghiệp giấy cũng sử dụng Cl2 để tẩy trắng bột giấy. Tuy nhiên, xu hướng hiện nay là thay thế bằng các chất thân thiện môi trường hơn.
Các hợp chất quan trọng của clo và ứng dụng
Clo tạo nên nhiều hợp chất clo có vai trò quan trọng trong đời sống và công nghiệp. Các hợp chất này được ứng dụng rộng rãi từ sản xuất đến sinh hoạt hàng ngày.
Axit clohiđric (HCl)
Axit clohiđric là một axit mạnh, được tạo thành khi khí HCl tan trong nước. công thức hóa học của axit clohiđric cho thấy đây là một phân tử đơn giản nhưng có tính axit rất mạnh.
Trong phòng thí nghiệm, tôi thường hướng dẫn học sinh pha loãng HCl đậm đặc bằng cách cho từ từ axit vào nước, không được làm ngược lại. Điều này giúp tránh bị bắn axit nguy hiểm.
Axit clohiđric được sử dụng để tẩy rửa kim loại, sản xuất phân bón và làm chất xúc tác trong nhiều phản ứng hóa học công nghiệp.
Muối clorua
Muối clorua là nhóm muối được tạo thành từ axit HCl. công thức bazơ phản ứng với HCl tạo ra muối clorua tương ứng.
Natri clorua (NaCl) là muối ăn quen thuộc trong bữa ăn hàng ngày. Canxi clorua (CaCl2) được dùng làm chất chống ẩm và làm tan băng trên đường.
Trong 20 năm giảng dạy, tôi nhận thấy học sinh dễ nhớ muối clorua khi liên hệ với các ứng dụng thực tế như muối ăn hay thuốc khử trùng.
Hợp chất clo với oxi
Clo tạo với oxi nhiều hợp chất có tính oxi hóa mạnh. Axit HClO4 là axit mạnh nhất trong dãy axit của clo với oxi.
Natri hipoclorit (NaClO) là thành phần chính trong nước Javen dùng để tẩy trắng, khử trùng. Khi dạy về hợp chất này, tôi thường cho học sinh quan sát chai nước Javen để dễ nhớ.
Công thức hóa học của clo với oxi rất đa dạng, từ ClO- đến ClO4-. Các hợp chất này được ứng dụng nhiều trong công nghiệp tẩy trắng, xử lý nước và sản xuất thuốc.
Vai trò của clo trong xử lý nước và môi trường
Clo đóng vai trò then chốt trong việc khử trùng nước sinh hoạt và xử lý môi trường. Chất này tiêu diệt hiệu quả vi khuẩn, virus và các mầm bệnh nguy hiểm trong nước.
Khi được thêm vào nước với nồng độ phù hợp, clo trong nước tạo ra acid hypochlorous có khả năng oxy hóa mạnh. Quá trình này phá hủy màng tế bào của vi sinh vật gây bệnh.
Trong lĩnh vực môi trường, clo trong hóa học còn được ứng dụng để xử lý nước thải công nghiệp và làm sạch bể bơi. Giống như nước mắt có vị mặn, clo tạo ra môi trường không thuận lợi cho vi sinh vật phát triển.
Cơ chế khử trùng nước bằng clo
Khi cho clo vào nước, nó sẽ phản ứng tạo thành acid hypochlorous (HOCl) và ion hypochlorite (OCl-). Đây là hai chất có tính oxy hóa mạnh.
Acid hypochlorous dễ dàng xâm nhập qua màng tế bào của vi sinh vật. Nó phá hủy các enzyme thiết yếu và làm rối loạn quá trình trao đổi chất.
Ion hypochlorite cũng góp phần tiêu diệt vi khuẩn thông qua phản ứng oxy hóa protein. Quá trình này làm biến tính protein và DNA của vi sinh vật.

Nồng độ clo an toàn trong nước sinh hoạt
Theo tiêu chuẩn của WHO, nồng độ clo dư trong nước uống an toàn nằm trong khoảng 0.2-0.5 mg/L. Mức này đủ để khử trùng nhưng không gây hại cho sức khỏe.
Tại các bể bơi công cộng, nồng độ clo được duy trì ở mức 1-3 mg/L. Điều này giúp đảm bảo môi trường nước luôn sạch sẽ và an toàn.
Kiểm tra nồng độ clo thường xuyên là việc làm cần thiết. Nồng độ quá cao có thể gây kích ứng da, mắt và đường hô hấp.
Tác động môi trường của clo
Clo có thể tạo ra các sản phẩm phụ độc hại khi phản ứng với chất hữu cơ trong nước. Trihalomethanes (THMs) là một ví dụ điển hình.
Việc xả thải nước chứa clo ra môi trường cần được kiểm soát chặt chẽ. Nồng độ clo cao có thể gây hại cho các sinh vật thủy sinh.
Các nhà máy xử lý nước thải hiện đại thường áp dụng quy trình khử clo trước khi xả thải. Phương pháp này giúp giảm thiểu tác động tiêu cực đến hệ sinh thái.
FAQ: Câu hỏi thường gặp về clo trong hóa học
Clo là một trong những nguyên tố hóa học phổ biến và quan trọng. Nó được ứng dụng rộng rãi trong nhiều lĩnh vực từ công nghiệp đến đời sống. Công thức clo là gì? Đó chính là Cl2 – một phân tử gồm 2 nguyên tử clo liên kết với nhau.
Clo có độc không?
Clo là chất khí độc màu vàng lục, có mùi hắc đặc trưng. Khi hít phải khí clo, nó sẽ kết hợp với nước trong phổi tạo thành axit clohidric gây bỏng đường hô hấp.
Nồng độ clo từ 0,1-0,3% trong không khí có thể gây tử vong sau 30 phút tiếp xúc. Clo được sử dụng làm vũ khí hóa học trong chiến tranh thế giới thứ nhất.
Làm sao nhận biết sự có mặt của clo?
Clo có thể được nhận biết qua màu sắc vàng lục đặc trưng và mùi hắc nồng. Khi tiếp xúc với giấy quỳ tím ẩm, clo làm giấy quỳ chuyển sang màu đỏ rồi nhanh chóng bị tẩy trắng.
Một cách khác là cho clo tác dụng với dung dịch KI. Phản ứng sẽ giải phóng iod làm dung dịch chuyển sang màu nâu đỏ. Đây là phản ứng đặc trưng để nhận biết clo.
Clo tác dụng với những chất nào?
Clo là một phi kim có độ âm điện lớn nên rất hoạt động. Nó tác dụng được với hầu hết kim loại tạo muối clorua như poli vinyl clorua có công thức.
Với phi kim, clo tạo thành các hợp chất clorua như HCl. Clo còn tham gia vào cấu trúc của nhiều hợp chất hữu cơ quan trọng như protein công thức.
Trong công nghiệp, clo được sử dụng để tẩy trắng giấy, vải và khử trùng nước sinh hoạt nhờ tính oxi hóa mạnh.
Kiến thức về công thức hóa học của clo giúp ta hiểu rõ bản chất và ứng dụng của nguyên tố này. Clo tồn tại ở nhiều dạng khác nhau trong tự nhiên và đóng vai trò quan trọng trong đời sống. Các phản ứng hóa học đặc trưng của clo tạo nên nhiều hợp chất có giá trị trong công nghiệp và xử lý môi trường. Việc nắm vững cấu tạo và tính chất của clo là nền tảng để ứng dụng hiệu quả trong thực tiễn.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.
Liên hệ ngay!
Liên hệ với chúng tôi để nhận được sự trợ giúp sớm nhất

