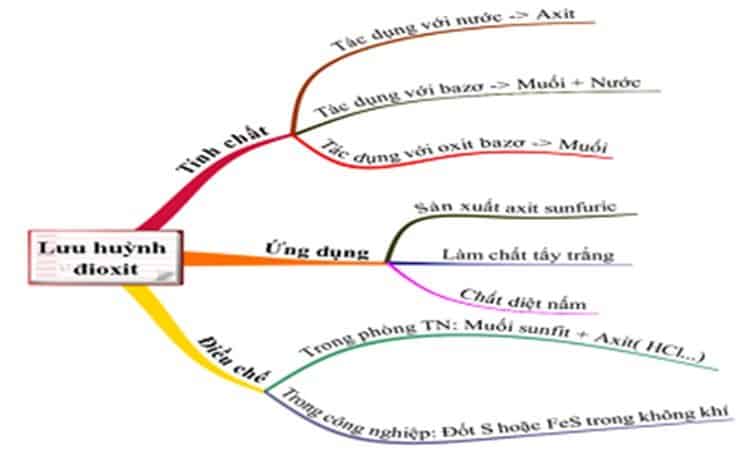
Nắm kỹ công thức hóa học của khí sunfurơ SO2 và tính chất ứng dụng
Công thức hóa học của khí sunfurơ đóng vai trò quan trọng trong công nghiệp và đời sống. Khí này có tính chất đặc biệt với khả năng tan tốt trong nước. SO2 mang lại nhiều lợi ích trong sản xuất nhưng cũng gây ảnh hưởng đến môi trường. Bài viết phân tích chi tiết về cấu tạo, tính chất và ứng dụng của hợp chất này.
Công thức hóa học của khí sunfurơ
Khí sunfurơ có công thức hóa học của khí sunfurơ là SO2. Đây là một hợp chất vô cơ phổ biến trong tự nhiên và công nghiệp.
Công thức SO2 là gì? SO2 được cấu tạo từ 1 nguyên tử lưu huỳnh (S) liên kết với 2 nguyên tử oxi (O). Cấu trúc phân tử có dạng góc với góc liên kết O-S-O là 119,5°.
Trong quá trình giảng dạy, tôi thường giúp học sinh ghi nhớ công thức này bằng cách liên hệ với mùi khó chịu của trứng thối. Khi trứng bị thối sẽ tạo ra khí H2S có mùi tương tự SO2.
Một số tính chất đặc trưng của SO2:
- Khí không màu
- Mùi hắc, gây cảm giác khó chịu
- Tan tốt trong nước tạo thành axit sunfurơ H2SO3
- Có tính oxi hóa và khử trung bình
Trong phòng thí nghiệm, tôi thường cho học sinh điều chế SO2 bằng phản ứng:
Na2SO3 + H2SO4 → Na2SO4 + SO2↑ + H2O
Đây là phương pháp an toàn và dễ thực hiện giúp học sinh hiểu rõ hơn về khí SO2 thông qua thực hành.
Cấu tạo và tính chất vật lý của khí sunfurơ
Khí sunfurơ (SO2) là một chất khí có vai trò quan trọng trong công nghiệp hóa chất. Nó được sử dụng rộng rãi trong sản xuất axit sunfuric và các hợp chất lưu huỳnh khác. Tương tự như công thức hóa học của không khí, SO2 cũng là một thành phần có trong khí quyển.
Cấu tạo phân tử SO2
Phân tử SO2 có cấu tạo góc với nguyên tử S ở trung tâm và hai nguyên tử O ở hai đầu. Góc liên kết O-S-O là 119,5°, gần với góc 120° của hình tam giác đều.
Liên kết S-O trong phân tử là liên kết cộng hóa trị có cực. Điện tích âm tập trung nhiều hơn ở nguyên tử O do độ âm điện lớn hơn S.
Màu sắc và mùi đặc trưng
Khí sunfurơ màu gì và có mùi như thế nào là câu hỏi thường gặp. SO2 là chất khí không màu ở điều kiện thường.
Khí này có khí sunfurơ mùi thế nào rất đặc trưng – mùi hắc và gây cảm giác cay nồng khi hít phải. Mùi này giống như mùi của que diêm đang cháy.
Khả năng tan trong nước
SO2 tan trong nước rất tốt. Ở 20°C, 1 thể tích nước có thể hòa tan được khoảng 40 thể tích SO2.
Khi hòa tan, SO2 tạo ra axit sunfurơ (H2SO3) theo phương trình:
SO2 + H2O ⇌ H2SO3
Phân tử khối và tỷ khối
SO2 phân tử khối bằng 64 đvC, được tính như sau:
M(SO2) = M(S) + 2M(O) = 32 + 2×16 = 64 (đvC)
Tỷ khối của SO2 so với không khí là:
d(không khí) = 64/29 = 2,21
Do đó SO2 nặng hơn không khí khoảng 2,21 lần.
Phương pháp điều chế và thu được khí sunfurơ trong phòng thí nghiệm
Trong phòng thí nghiệm, khí sunfurơ điều chế có thể thực hiện qua nhiều phương pháp khác nhau. Mỗi phương pháp đều có những ưu điểm và hạn chế riêng.
Việc lựa chọn phương pháp điều chế phù hợp sẽ giúp thu được khí SO2 tinh khiết. Quá trình này cần tuân thủ nghiêm ngặt các quy tắc an toàn phòng thí nghiệm.
Tôi thường nhắc học sinh rằng khí SO2 rất độc, giống như công thức hóa học của điphotpho pentaoxit. Vì vậy cần thực hiện trong tủ hút và đeo găng tay, kính bảo hộ.
Điều chế từ lưu huỳnh và oxi
Phương pháp này dựa trên phản ứng đốt cháy lưu huỳnh trong không khí hoặc oxi:
S + O2 → SO2
Lưu huỳnh được đốt nóng trong bình thủy tinh chịu nhiệt. Khi cháy sẽ tạo ra khí SO2 màu vàng nhạt, mùi hắc đặc trưng.
Ưu điểm của phương pháp này là đơn giản, dễ thực hiện. Tuy nhiên khí thu được thường lẫn tạp chất từ không khí.
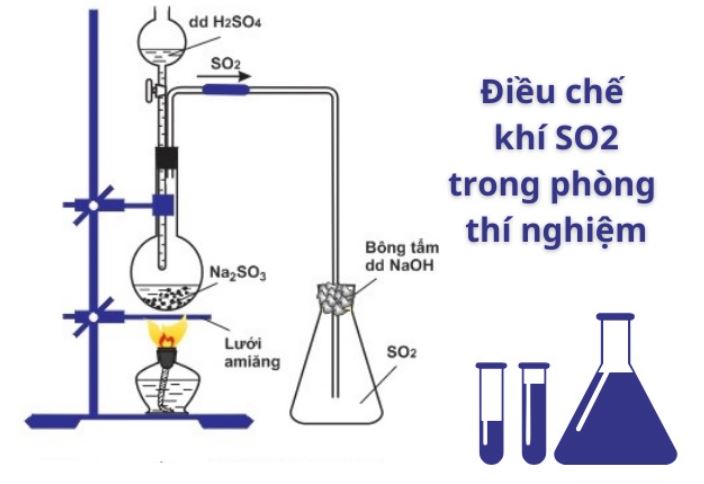
Điều chế từ các muối sunfit
Phương pháp này sử dụng phản ứng giữa muối sunfit với axit:
Na2SO3 + 2HCl → 2NaCl + H2O + SO2
Cho từ từ dung dịch axit HCl vào bình đựng Na2SO3. Khí SO2 sinh ra sẽ được dẫn qua bình rửa khí.
Đây là phương pháp tôi thường hướng dẫn học sinh thực hành. Khí thu được tinh khiết hơn so với đốt lưu huỳnh.
Cần điều chỉnh tốc độ nhỏ giọt axit để tránh phản ứng quá nhanh gây mất mát khí SO2.
Tính chất hóa học và phản ứng của khí sunfurơ
Khí sunfurơ tính chất nổi bật là tính khử mạnh và khả năng tác dụng với nhiều chất. Khí này có mùi hắc đặc trưng và độc tính cao khi hít phải. Tôi thường ví von với học sinh rằng đây là “kẻ hai mặt” trong hóa học – vừa có thể khử vừa có thể oxi hóa.
Phản ứng với nước
SO2 tan nhiều trong nước tạo thành dung dịch axit sunfurơ H2SO3. Phản ứng xảy ra theo phương trình:
SO2 + H2O ⇌ H2SO3
Axit sunfurơ là axit trung bình, có tính axit mạnh hơn axit cacbonic. Trong dung dịch, nó phân ly theo hai nấc:
H2SO3 ⇌ H+ + HSO3-
HSO3- ⇌ H+ + SO32-
Đây là tiền chất quan trọng để điều chế công thức hóa học của axit sunfuric trong công nghiệp.
Phản ứng oxi hóa – khử
SO2 thể hiện tính oxi hóa khi tác dụng với các chất khử mạnh như H2S:
2H2S + SO2 → 3S + 2H2O
Với các chất oxi hóa mạnh như KMnO4, SO2 lại thể hiện tính khử:
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
Tôi thường nhắc học sinh ghi nhớ: SO2 “nhảy múa” giữa S+4 và S+6 trong các phản ứng oxi hóa khử.
Phản ứng với bazơ
SO2 tác dụng với dung dịch bazơ tạo muối sunfit và hydrosunfit. Ví dụ với NaOH:
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
Muối sunfit có thể chuyển hóa thành công thức hóa học nhôm sunfat qua phản ứng oxi hóa khử. Trong giảng dạy, tôi thường cho học sinh làm thí nghiệm này để minh họa tính chất của SO2.
Ứng dụng và tác hại của khí sunfurơ trong đời sống
Khí sunfurơ ứng dụng rộng rãi trong nhiều lĩnh vực công nghiệp và nông nghiệp. Tuy nhiên, chất khí này cũng gây nhiều tác hại nghiêm trọng cho sức khỏe con người và môi trường.
Ứng dụng trong công nghiệp
SO2 là nguyên liệu quan trọng trong sản xuất axit sunfuric. Quá trình này tạo ra công thức đồng sunfat và các muối sunfat khác.
Trong công nghiệp giấy, SO2 được sử dụng để tẩy trắng bột giấy. Phương pháp này giúp loại bỏ lignin và tạo ra giấy trắng sạch.
Khí sunfurơ còn là chất bảo quản thực phẩm hiệu quả. Nó ngăn chặn sự phát triển của vi sinh vật gây hại trong rượu vang và trái cây khô.
Ứng dụng trong nông nghiệp
SO2 được dùng để khử trùng kho bảo quản nông sản. Nó tiêu diệt nấm mốc và côn trùng gây hại.
Trong xử lý đất, khí sunfurơ giúp điều chỉnh độ pH. Quá trình này tạo ra công thức hóa học của natri sunfat làm giảm độ kiềm của đất.
Nông dân thường phun SO2 để diệt nấm bệnh trên cây trồng. Tuy nhiên cần tuân thủ nồng độ an toàn để tránh ảnh hưởng xấu.

Tác hại đối với sức khỏe và môi trường
SO2 độc không? Câu trả lời là có. SO2 gây kích ứng đường hô hấp nghiêm trọng khi hít phải.
Khí này là nguyên nhân chính gây mưa axit. Mưa axit phá hủy công trình xây dựng và làm chết cây trồng.
SO2 còn góp phần tạo ra khói quang hóa. Hiện tượng này làm giảm tầm nhìn và ảnh hưởng đến sức khỏe cộng đồng.
Theo WHO, phơi nhiễm SO2 kéo dài có thể gây viêm phổi mãn tính. Trẻ em và người già đặc biệt nhạy cảm với tác hại này.
FAQ: Câu hỏi thường gặp về khí sunfurơ
Khí sunfurơ (SO2) là một chất khí độc hại phổ biến trong môi trường. Tôi sẽ giải đáp một số thắc mắc quan trọng về loại khí này.
Khí sunfurơ có phải là khí nhà kính không?
Khí sunfurơ không phải là khí nhà kính trực tiếp. Nó tạo ra các hạt sol khí trong khí quyển và gián tiếp làm mát Trái đất.
SO2 phản ứng với nước trong khí quyển tạo thành axit sunfuric, góp phần gây mưa axit. Điều này ảnh hưởng xấu đến môi trường sinh thái.
Làm thế nào để phát hiện sự có mặt của SO2?
SO2 có mùi hắc đặc trưng giống diêm cháy. Đây là dấu hiệu dễ nhận biết nhất.
Trong phòng thí nghiệm, tôi thường hướng dẫn học sinh dùng giấy tẩm KMnO4 để phát hiện SO2. Giấy sẽ chuyển từ tím sang không màu.
Ngoài ra có thể dùng dung dịch nước brom, SO2 sẽ làm mất màu nâu đỏ của brom. Giống như công thức hóa học của khí cười, SO2 cũng dễ nhận biết qua phản ứng đặc trưng.
Cách xử lý khi bị nhiễm độc SO2?
Di chuyển nạn nhân ra khỏi khu vực có khí SO2 ngay lập tức. Đưa đến nơi thoáng khí.
Nếu bị kích ứng mắt, rửa mắt bằng nước sạch trong 15 phút. Tránh dụi mắt.
Trong trường hợp khó thở, cần đưa đến cơ sở y tế gần nhất để được điều trị kịp thời. SO2 có thể gây tổn thương phổi nghiêm trọng.
Kiến thức về công thức hóa học của khí sunfurơ giúp chúng ta hiểu rõ bản chất và vai trò của hợp chất này. SO2 là một chất khí quan trọng trong công nghiệp và đời sống với những tính chất đặc trưng. Việc nắm vững cấu tạo, phương pháp điều chế và các phản ứng hóa học của SO2 tạo nền tảng cho việc ứng dụng an toàn và hiệu quả trong thực tiễn. Tuy nhiên cần chú ý đến tác hại của khí này với sức khỏe và môi trường để có biện pháp phòng tránh phù hợp.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

