Nắm kỹ công thức hóa học của natri sunfat và các tính chất quan trọng
Công thức hóa học của natri sunfat là một kiến thức nền tảng trong chương trình hóa học phổ thông. Muối này có nhiều ứng dụng quan trọng trong công nghiệp và đời sống. Các tính chất đặc trưng của natri sunfat giúp nó trở thành một hợp chất không thể thiếu trong nhiều ngành sản xuất.
Công thức hóa học của natri sunfat
Công thức hóa học của natri sunfat là Na2SO4. Đây là một muối vô cơ được tạo thành từ ion natri (Na+) và ion sunfat (SO42-).
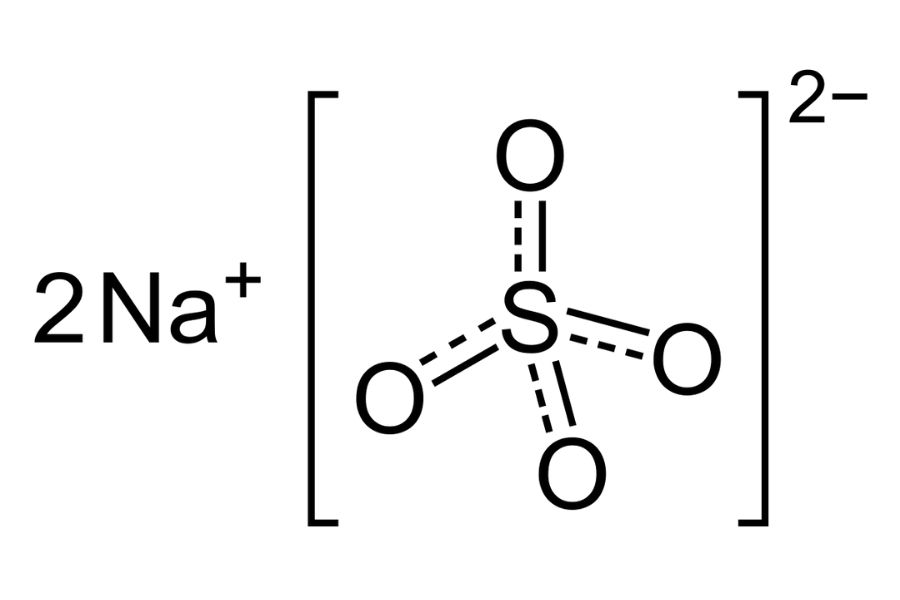
Công thức cấu tạo của natri sunfat:
Na2SO4
Trong đó:
- Na: nguyên tố Natri, hóa trị +1
- S: nguyên tố Lưu huỳnh, hóa trị +6
- O: nguyên tố Oxi, hóa trị -2
Natri sunfat tồn tại phổ biến dưới dạng tinh thể màu trắng, dễ tan trong nước. Khi hòa tan vào nước, muối này phân ly thành các ion:
Na2SO4 → 2Na+ + SO42-
Trong quá trình giảng dạy, tôi thường giúp học sinh ghi nhớ công thức này bằng cách liên hệ với tính chất của các ion. Ion Na+ có điện tích +1 nên cần 2 ion để cân bằng với ion SO42- có điện tích -2.
Một cách đơn giản để viết công thức là: Viết ion dương trước (Na), sau đó viết ion âm (SO4). Cuối cùng, cân bằng điện tích bằng cách thêm số 2 vào trước Na.
Cấu tạo và tính chất của natri sunfat
Natri sunfat là một muối vô cơ có công thức hóa học Na2SO4. Muối này được tạo thành từ phản ứng giữa công thức hoá học của axit sunfuric với natri hidroxit.
Cấu tạo phân tử natri sunfat
Cấu tạo natri sunfat gồm 2 ion Na+ và 1 ion SO42-. Ion sunfat có cấu trúc tứ diện với nguyên tử S ở tâm và 4 nguyên tử O ở 4 đỉnh.
Liên kết trong phân tử là liên kết ion giữa Na+ và SO42-. Góc liên kết O-S-O xấp xỉ 109°28′.
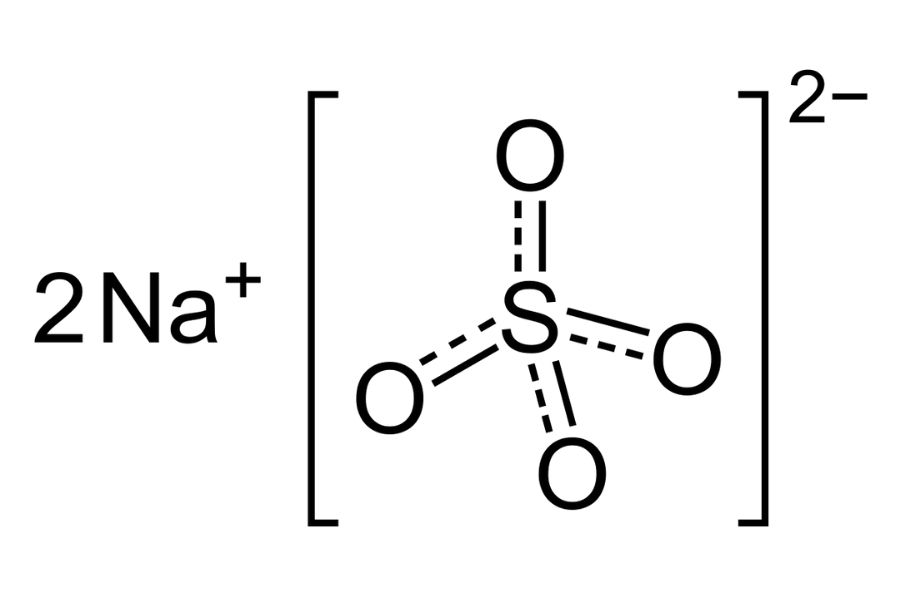
Trong tinh thể, các ion Na+ và SO42- sắp xếp theo mạng tinh thể lập phương tâm mặt.
Tính chất vật lý của natri sunfat
Natri sunfat tồn tại ở dạng tinh thể màu trắng, không mùi. Khối lượng riêng 2,7 g/cm3.
Muối này có nhiệt độ nóng chảy 884°C và nhiệt độ sôi 1429°C ở áp suất thường.
Natri sunfat có tan trong nước không? Câu trả lời là có, độ tan trong nước ở 20°C là 19,2g/100g nước.
Tính chất hóa học cơ bản
Natri sunfat là một muối bền vững trong điều kiện thường. Tương tự như công thức sắt 2 sunfat, nó tham gia các phản ứng trao đổi ion điển hình.
Khi đun nóng với cacbon ở nhiệt độ cao, natri sunfat bị khử thành natri sunfit:
Na2SO4 + C → Na2SO3 + CO
Phản ứng với dung dịch BaCl2 tạo kết tủa trắng BaSO4:
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
Phương pháp điều chế và sự tồn tại trong tự nhiên của natri sunfat
Natri sunfat là một muối vô cơ quan trọng, được sử dụng rộng rãi trong công nghiệp và đời sống. Muối này có thể được điều chế bằng nhiều phương pháp khác nhau và tồn tại phổ biến trong tự nhiên.
Các phương pháp điều chế natri sunfat trong phòng thí nghiệm
Cách điều chế natri sunfat phổ biến nhất là cho axit sunfuric tác dụng với công thức hóa học natri cacbonat. Phản ứng xảy ra theo phương trình:
H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2↑
Một phương pháp khác là cho dung dịch NaOH tác dụng với H2SO4:
2NaOH + H2SO4 → Na2SO4 + 2H2O
Trong quá trình giảng dạy, tôi thường hướng dẫn học sinh thực hiện phương pháp thứ nhất vì dễ quan sát CO2 thoát ra.
Sự tồn tại của natri sunfat trong tự nhiên
Natri sunfat trong tự nhiên tồn tại dưới dạng khoáng vật mirabilit (Na2SO4.10H2O). Khoáng chất này được tìm thấy trong:
- Các mỏ muối tự nhiên
- Nước biển và hồ nước mặn
- Vùng sa mạc khô cằn
Mirabilit thường xuất hiện dưới dạng tinh thể trong suốt hoặc trắng đục, có vị mặn đắng đặc trưng.
Quy trình sản xuất công nghiệp
Trong công nghiệp, natri sunfat được sản xuất chủ yếu từ phản ứng giữa NaCl và công thức của nhôm sunfat là. Quy trình này được thực hiện ở nhiệt độ cao.
Phương trình phản ứng:
6NaCl + Al2(SO4)3 → 3Na2SO4 + 2AlCl3
Sản phẩm thu được sẽ qua các công đoạn tinh chế như kết tinh, ly tâm và sấy khô để đạt độ tinh khiết cao.
Ứng dụng và tác động của natri sunfat
Natri sunfat là một hợp chất vô cơ có nhiều ứng dụng quan trọng trong đời sống và công nghiệp. Hợp chất này có thể tương tác với nhiều chất khác như natri oxit là gì để tạo ra các sản phẩm hữu ích.
Ứng dụng trong công nghiệp
Trong ngành công nghiệp giấy, natri sunfat đóng vai trò quan trọng trong quá trình sản xuất bột giấy kraft. Hợp chất này giúp tách lignin ra khỏi cellulose, tạo ra bột giấy chất lượng cao.
Natri sunfat còn được sử dụng làm chất tẩy rửa công nghiệp. Khi kết hợp với công thức hóa học của đồng sunfat, nó tạo thành dung dịch làm sạch hiệu quả.
Trong sản xuất thủy tinh, natri sunfat giúp loại bỏ bọt khí và làm trong suốt sản phẩm. Theo nghiên cứu của Viện Khoa học Vật liệu, việc bổ sung 0.5-1% natri sunfat có thể cải thiện độ trong của thủy tinh lên 30%.
Ứng dụng trong y học
Natri sunfat được sử dụng phổ biến trong ngành dược phẩm làm thuốc nhuận tràng. Liều lượng thông thường là 10-30g cho người lớn, tùy theo chỉ định của bác sĩ.
Trong phòng thí nghiệm y học, hợp chất này còn dùng làm chất điều chỉnh độ pH và dung dịch đệm. Điều này giúp duy trì môi trường ổn định cho các phản ứng sinh hóa.
Tác động đến môi trường và sức khỏe
Natri sunfat có độ độc thấp đối với con người khi sử dụng đúng liều lượng. Tuy nhiên, nồng độ cao có thể gây kích ứng da và niêm mạc.

Đối với môi trường, natri sunfat không gây ô nhiễm nghiêm trọng do có khả năng phân hủy sinh học. Nó không tích tụ trong chuỗi thức ăn hay gây độc cho sinh vật thủy sinh.
Theo báo cáo của Cục Bảo vệ Môi trường Mỹ, natri sunfat được xếp vào nhóm các hóa chất an toàn với môi trường khi sử dụng đúng quy trình và liều lượng khuyến cáo.
Các phản ứng hóa học quan trọng của natri sunfat
Phản ứng của natri sunfat là những phản ứng hóa học đặc trưng giúp nhận biết muối Na2SO4 trong dung dịch. Tôi thường ví von Na2SO4 như một “vũ công” linh hoạt – có thể phản ứng với nhiều chất khác nhau.

Muối natri sunfat tham gia vào 3 nhóm phản ứng chính với axit, bazơ và muối. Các phản ứng này có ý nghĩa quan trọng trong phân tích định tính các ion.
Phản ứng với axit
Na2SO4 phản ứng với axit mạnh như HCl tạo thành muối mới và axit yếu H2SO4. Phản ứng xảy ra theo phương trình:
Na2SO4 + 2HCl → 2NaCl + H2SO4
Khi thực hiện phản ứng này, tôi thường nhắc học sinh chú ý đến hiện tượng tạo kết tủa BaSO4 màu trắng khi cho thêm dung dịch BaCl2 vào. Đây là phản ứng đặc trưng để nhận biết ion SO42-.
Phản ứng với bazơ
Na2SO4 có thể phản ứng với bazơ mạnh như Ba(OH)2 tạo kết tủa BaSO4 màu trắng không tan:
Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
Phản ứng này rất quan trọng trong công thức hóa học của khí sunfurơ và các hợp chất sunfua.
Phản ứng với muối khác
Na2SO4 phản ứng với nhiều muối khác tạo kết tủa. Phản ứng điển hình là với muối bari clorua:
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
Phản ứng này thường được sử dụng trong công thức natri cromat là gì để tách ion sunfat ra khỏi dung dịch.
Khi giảng dạy, tôi luôn nhấn mạnh với học sinh về hiện tượng tạo kết tủa trắng BaSO4 – đây là dấu hiệu nhận biết quan trọng của ion SO42-.
FAQ: Câu hỏi thường gặp về natri sunfat
Natri sunfat là hợp chất hóa học phổ biến trong công nghiệp và đời sống. Dưới đây là một số câu hỏi thường gặp về chất này.
Natri sunfat là muối gì?
Natri sunfat là muối gì của axit sunfuric và natri hidroxit. Công thức hóa học của nó là Na2SO4.
Muối này có cấu tạo gồm 2 ion Na+ và 1 ion SO42-. Tương tự như công thức hóa học của natri clorua, natri sunfat cũng là muối trung hòa.
Natri sunfat tồn tại ở dạng tinh thể màu trắng và dễ tan trong nước. muối natri hidrophotphat có công thức là Na2HPO4 cũng có tính chất tương tự.
Cách bảo quản natri sunfat an toàn
Natri sunfat cần được bảo quản trong điều kiện khô ráo, thoáng mát. Nhiệt độ bảo quản thích hợp từ 15-25°C.
Đựng muối trong các bình kín có nắp đậy chắc chắn. Tránh để muối tiếp xúc trực tiếp với không khí ẩm.
Không để lẫn natri sunfat với các hóa chất khác. Cần dán nhãn rõ ràng để tránh nhầm lẫn khi sử dụng.
Những lưu ý khi sử dụng natri sunfat
Mang găng tay và kính bảo hộ khi thao tác với natri sunfat. Tránh để muối tiếp xúc trực tiếp với da.
Không được nếm thử hoặc hít bụi natri sunfat. Nếu vô tình nuốt phải cần uống nhiều nước và đến cơ sở y tế.
Rửa sạch tay sau khi sử dụng. Bảo quản xa tầm với của trẻ em và động vật nuôi trong nhà.
Kiến thức về công thức hóa học của natri sunfat Na2SO4 là nền tảng quan trọng trong chương trình hóa học phổ thông. Muối này có cấu tạo ion đơn giản, tính chất ổn định và ứng dụng rộng rãi trong công nghiệp, y học. Việc nắm vững cấu tạo, tính chất và phản ứng của natri sunfat giúp học sinh dễ dàng vận dụng trong học tập và thực tiễn. Các phương pháp điều chế đơn giản cùng sự phổ biến trong tự nhiên làm cho natri sunfat trở thành một hợp chất quan trọng trong đời sống.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

