Tổng quan về kali xyanua công thức và ứng dụng trong hóa học cơ bản
Kali xyanua công thức KCN là một hợp chất vô cơ quan trọng trong công nghiệp. Chất này có cấu tạo đơn giản nhưng độc tính cao và ứng dụng đa dạng. Bài viết phân tích chi tiết về cấu trúc, tính chất và cách sử dụng an toàn của KCN trong thực tế.
Kali xyanua công thức và cấu tạo phân tử KCN
Kali xyanua là một hợp chất vô cơ có công thức hóa học của kali xyanua là KCN. Đây là một muối của axit xyanhydric HCN và kali hydroxide KOH.
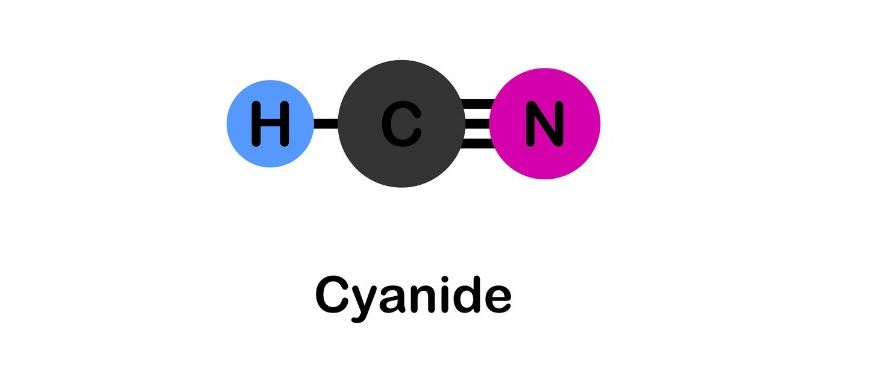
Kali xyanua công thức cấu tạo gồm ion K+ và ion CN-. Ion xyanua CN- có cấu trúc thẳng với liên kết ba giữa C và N.
Về mặt cấu tạo phân tử, cấu tạo KCN có dạng ion tinh thể. Ion K+ nằm ở tâm của mạng tinh thể và được bao quanh bởi các ion CN-.
Trong phân tử KCN, liên kết giữa K+ và CN- là liên kết ion. Còn trong ion CN-, C và N liên kết với nhau bằng liên kết cộng hóa trị ba rất bền vững.
Từ kinh nghiệm giảng dạy, tôi thường giúp học sinh ghi nhớ cấu tạo KCN bằng cách:
- Vẽ ion K+ là một chấm tròn
- Vẽ ion CN- là một que thẳng
- Nhấn mạnh liên kết ion giữa K+ và CN-
Cách vẽ trực quan này giúp học sinh dễ hình dung và nhớ lâu cấu tạo của KCN. Đặc biệt khi giải các bài tập về phản ứng của KCN.
Tính chất vật lý và hóa học của kali xyanua (KCN)
Kali xyanua là một hợp chất vô cơ có tính chất KCN đặc biệt nguy hiểm. Chất này có công thức hóa học là KCN và được sử dụng trong nhiều ngành công nghiệp. Tuy nhiên, việc sử dụng KCN cần tuân thủ nghiêm ngặt các quy tắc an toàn.

Tính chất vật lý đặc trưng của KCN
KCN tồn tại ở dạng tinh thể màu trắng, không mùi trong điều kiện khô ráo. Khi tiếp xúc với độ ẩm, nó sẽ tỏa ra mùi hạnh nhân đặc trưng do phân hủy thành HCN.
Nhiệt độ nóng chảy của KCN là 634°C và nhiệt độ sôi khoảng 1625°C. Chất này tan rất tốt trong nước với độ tan 71.6g/100ml ở 25°C, tạo thành dung dịch trong suốt.
Các phản ứng hóa học quan trọng của KCN
KCN hóa học tham gia nhiều phản ứng quan trọng. Khi tác dụng với axit, KCN giải phóng khí HCN độc:
KCN + HCl → HCN↑ + KCl
Trong công nghiệp mạ điện, phân kali công thức KCN được dùng để tạo phức với ion kim loại:
KCN + Au → K[Au(CN)2]
Độc tính và cách bảo quản an toàn KCN
Phản ứng của KCN với axit trong cơ thể sinh ra HCN gây ngộ độc cấp tính. Liều gây tử vong chỉ khoảng 200-300mg đối với người trưởng thành.
KCN cần được bảo quản trong bình kín, tránh ẩm và axit. Khi sử dụng phải mang đầy đủ thiết bị bảo hộ như găng tay, kính, khẩu trang.
Trong phòng thí nghiệm luôn cần có sẵn thuốc giải độc natri thiosulfat và amyl nitrit để xử lý khi có sự cố. Việc thao tác với KCN phải được thực hiện trong tủ hút.
Quy trình điều chế và sản xuất kali xyanua trong công nghiệp
Kali xyanua công thức KCN là một hợp chất vô cơ độc hại, được sử dụng rộng rãi trong công nghiệp khai thác vàng và mạ điện. Việc điều chế và sản xuất KCN đòi hỏi quy trình nghiêm ngặt về an toàn.
Có hai phương pháp chính để điều chế và sản xuất KCN: phương pháp phòng thí nghiệm và quy trình công nghiệp. Mỗi phương pháp có những đặc điểm và yêu cầu kỹ thuật riêng.
Phương pháp điều chế KCN trong phòng thí nghiệm
Trong phòng thí nghiệm, KCN được điều chế bằng phản ứng trung hòa giữa axit HCN và KOH:
HCN + KOH → KCN + H2O
Phản ứng cần được thực hiện trong tủ hút với thiết bị bảo hộ đầy đủ. Axit HCN được tạo ra từ phản ứng giữa natri xyanua và axit sulfuric loãng.
Sau khi phản ứng hoàn tất, dung dịch được cô cạn cẩn thận để thu được tinh thể KCN tinh khiết. Sản phẩm cần được bảo quản trong bình kín, tránh ẩm.
Quy trình sản xuất KCN công nghiệp
Trong công nghiệp, KCN được sản xuất qua hai giai đoạn chính:
Giai đoạn 1: Tổng hợp HCN từ methan và amoniac
CH4 + NH3 + 1.5O2 → HCN + 3H2O

Giai đoạn 2: Trung hòa HCN với KOH
HCN + KOH → KCN + H2O
Quy trình đòi hỏi hệ thống thiết bị hiện đại với các biện pháp an toàn nghiêm ngặt. Nhiệt độ phản ứng được kiểm soát ở 1000-1200°C.
Sản phẩm KCN thương mại thường có độ tinh khiết 95-98%. Các tạp chất chính là K2CO3 và KCNO được tạo ra do phản ứng phụ.
Ứng dụng của kali xyanua trong đời sống và công nghiệp
Kali xyanua trong thực tế có nhiều ứng dụng quan trọng trong các ngành công nghiệp. Tuy nhiên, do tính độc hại cao nên việc sử dụng cần tuân thủ nghiêm ngặt các quy định an toàn.
Ứng dụng trong khai thác vàng
KCN là hóa chất quan trọng trong quy trình tách vàng khỏi quặng. Khi hòa tan trong nước, KCN tạo phức chất với vàng theo phương trình:
4Au + 8KCN + O2 + 2H2O → 4K[Au(CN)2] + 4KOH
Phức chất K[Au(CN)2] tan tốt trong nước, giúp tách vàng khỏi tạp chất. Sau đó, người ta dùng kẽm để khử vàng tinh khiết:
2K[Au(CN)2] + Zn → K2[Zn(CN)4] + 2Au
Ứng dụng trong công nghiệp mạ điện
KCN được sử dụng làm dung dịch điện phân trong mạ điện các kim loại quý như vàng, bạc. Quá trình này tạo lớp phủ mỏng, bền và đẹp trên bề mặt sản phẩm.

Trong ngành công nghiệp mạ vàng, ứng dụng kali xyanua giúp tạo ra các sản phẩm trang sức cao cấp. Dung dịch điện phân thường chứa 1-2% KCN và các muối vàng.
Các ứng dụng khác của KCN
KCN còn được dùng trong công nghiệp nhiếp ảnh để tráng rửa phim. Hợp chất này giúp tạo phức với ion bạc, làm sạch và ổn định hình ảnh.
Trong công nghiệp dệt may, KCN được sử dụng để tẩy trắng vải sợi. Phản ứng với các hợp chất màu giúp loại bỏ tạp chất và làm trắng sáng vải.
Ngoài ra, KCN còn được dùng trong tổng hợp hữu cơ để sản xuất các hợp chất nitrile và trong công nghiệp khai thác một số kim loại quý khác.
FAQ: Câu hỏi thường gặp về kali xyanua
Kali xyanua là gì? Đây là một hợp chất vô cơ có công thức hóa học KCN, tồn tại dưới dạng tinh thể màu trắng và có độc tính cực mạnh. Trong quá trình giảng dạy, tôi luôn nhấn mạnh với sinh viên về tính nguy hiểm của chất này.
Kali xyanua có độc không?
Kali xyanua là một trong những chất độc mạnh nhất. Chỉ cần 200-300mg kali xyanua có thể gây tử vong cho người trưởng thành trong vòng vài phút.
Cơ chế gây độc của KCN là ức chế enzyme cytochrome oxidase, ngăn cản quá trình hô hấp tế bào. Điều này dẫn đến thiếu oxy nghiêm trọng và tổn thương não không hồi phục.
Cách nhận biết kali xyanua
Kali xyanua có một số đặc điểm nhận biết đặc trưng:
- Tinh thể màu trắng, dễ hút ẩm
- Mùi đặc trưng giống hạnh nhân đắng
- Tan tốt trong nước, tạo dung dịch trong suốt
- pH dung dịch mạnh kiềm (pH > 11)
Trong phòng thí nghiệm, tôi thường hướng dẫn sinh viên nhận biết KCN bằng phản ứng với muối sắt (III) tạo phức màu đỏ máu đặc trưng.
Biện pháp sơ cứu khi nhiễm độc KCN
Khi phát hiện người bị nhiễm độc KCN, cần thực hiện ngay các biện pháp:
Đưa nạn nhân ra khỏi khu vực nhiễm độc và gọi cấp cứu ngay. Kiểm tra ý thức và hô hấp của nạn nhân.
Nếu nạn nhân ngừng thở, tiến hành hô hấp nhân tạo. Tuy nhiên người cấp cứu phải đeo găng tay và mặt nạ bảo hộ để tránh nhiễm độc.
Cho nạn nhân uống than hoạt tính nếu còn tỉnh táo. Than hoạt có khả năng hấp phụ độc tố, giảm hấp thu vào máu.
Kiến thức về kali xyanua công thức là nền tảng quan trọng trong chương trình hóa học phổ thông và đại học. Hợp chất này có cấu tạo đơn giản nhưng tính chất phức tạp, đặc biệt là độc tính cao cần được lưu ý khi sử dụng. KCN đóng vai trò thiết yếu trong nhiều ngành công nghiệp như khai thác vàng và mạ điện. Việc nắm vững cấu tạo, tính chất và ứng dụng của KCN giúp người học có cái nhìn toàn diện về hóa học vô cơ.
Bài viết liên quan
Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

