Thuộc lòng công thức của nhôm sunfat là Al2(SO4)3 và ứng dụng
Công thức của nhôm sunfat là một kiến thức cơ bản trong chương trình hóa học phổ thông. Hợp chất này có vai trò quan trọng trong công nghiệp và đời sống. Bài viết phân tích chi tiết cấu tạo, tính chất và các phản ứng đặc trưng của muối nhôm sunfat.
Công thức của nhôm sunfat là Al2(SO4)3
Nhôm sunfat có công thức hóa học của nhôm sunfat là Al2(SO4)3. Đây là một muối vô cơ được tạo thành từ ion Al3+ và ion SO42-.
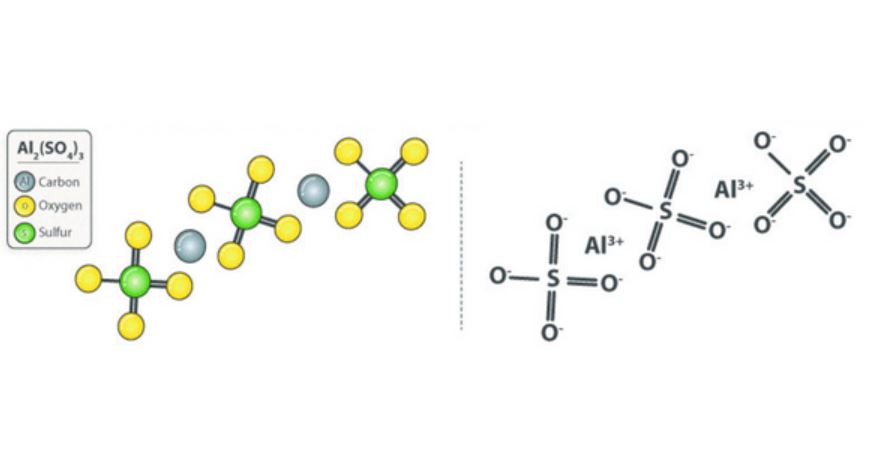
Công thức của nhôm sunfat là Al2(SO4)3 với cấu tạo gồm:
- 2 nguyên tử nhôm (Al)
- 3 gốc sunfat (SO4)
- Mỗi gốc sunfat mang điện tích -2
Trong phòng thí nghiệm, tôi thường giúp học sinh ghi nhớ công thức này bằng cách phân tích hóa trị:
- Nhôm có hóa trị +3
- Gốc sunfat có hóa trị -2
- Cần 2 nguyên tử Al và 3 gốc SO4 để cân bằng điện tích
Khi viết phương trình phản ứng, các em cần chú ý viết đúng công thức Al2(SO4)3 với dấu ngoặc đơn bao quanh gốc SO4. Đây là một trong những lỗi phổ biến mà học sinh hay mắc phải.
Nhôm sunfat là một muối quan trọng, được ứng dụng rộng rãi trong công nghiệp và đời sống. Các em có thể bắt gặp nó trong các chất làm trong nước, chất cầm máu hay phèn chua dùng trong nhuộm vải.
Cấu tạo và tính chất hóa học của nhôm sunfat
Nhôm sunfat là một hợp chất vô cơ có công thức hóa học Al2(SO4)3. Đây là muối được tạo thành từ phản ứng giữa nhôm hidroxit và axit sunfuric.
Cấu trúc phân tử của nhôm sunfat
Nhôm sunfat cấu tạo gồm 2 nguyên tử nhôm (Al3+) liên kết với 3 gốc sunfat (SO42-). Mỗi ion Al3+ được bao quanh bởi 6 nguyên tử oxi từ các gốc SO42-.
Cấu trúc tinh thể của muối này có dạng bát diện, trong đó các ion nhôm nằm ở tâm và các gốc sunfat ở các đỉnh. Điều này tạo nên một mạng tinh thể ổn định và bền vững.
Phân tử khối và hóa trị của nhôm sunfat
Nhôm sunfat phân tử khối được tính: Al = 27 x 2 = 54; S = 32 x 3 = 96; O = 16 x 12 = 192. Tổng phân tử khối là 342 đvC.
Nhôm sunfat hóa trị thể hiện qua số điện tích của các ion: Al3+ có hóa trị +3 và SO42- có hóa trị -2. Trong đó công thức của nhôm oxit đóng vai trò quan trọng trong việc hình thành muối.

Tính chất vật lý của nhôm sunfat
Nhôm sunfat là muối tinh thể màu trắng, không mùi. Ở nhiệt độ phòng, nó tồn tại dưới dạng tinh thể ngậm 18 phân tử nước Al2(SO4)3.18H2O.
Muối này tan tốt trong nước và tạo dung dịch trong suốt. Nhiệt độ nóng chảy khoảng 770°C và bị phân hủy ở nhiệt độ cao hơn.
Tính chất hóa học đặc trưng
Nhôm sunfat tính chất nổi bật là khả năng thủy phân trong nước tạo môi trường axit:
Al2(SO4)3 + 6H2O ⇌ 2Al(OH)3 + 3H2SO4
Muối này phản ứng với bazơ tạo kết tủa nhôm hidroxit:
Al2(SO4)3 + 6NaOH → 2Al(OH)3↓ + 3Na2SO4
Khi đun nóng đến 770°C, nhôm sunfat bị phân hủy thành oxit nhôm và khí SO3:
Al2(SO4)3 → Al2O3 + 3SO3↑
Các phản ứng hóa học quan trọng của nhôm sunfat
Nhôm sunfat phản ứng với nhiều chất khác nhau tạo thành các sản phẩm mới. Tương tự như công thức sắt 2 sunfat, công thức của nhôm sunfat là Al2(SO4)3 có tính chất của một muối.
Các phản ứng của nhôm sunfat thường xảy ra mạnh mẽ và tạo ra nhiều sản phẩm có giá trị trong công nghiệp. Giống như công thức hóa học của đồng sunfat, nhôm sunfat tham gia vào nhiều phản ứng quan trọng.
Phản ứng với bazơ
Khi tác dụng với dung dịch bazơ, nhôm sunfat tạo thành kết tủa Al(OH)3 màu trắng:
Al2(SO4)3 + 6NaOH → 2Al(OH)3↓ + 3Na2SO4
Kết tủa nhôm hidroxit có tính chất lưỡng tính, có thể tan trong axit và bazơ dư. Đây là phản ứng đặc trưng để nhận biết ion Al3+ trong dung dịch.
Phản ứng với muối
Nhôm sunfat phản ứng với muối bari clorua tạo kết tủa trắng bari sunfat:
Al2(SO4)3 + 3BaCl2 → 2AlCl3 + 3BaSO4↓
Phản ứng này thường được sử dụng để kiểm tra sự có mặt của ion SO42- trong dung dịch. Kết tủa BaSO4 không tan trong nước và axit.
Phản ứng thủy phân
Trong dung dịch, nhôm sunfat bị thủy phân theo phương trình:
Al2(SO4)3 + 6H2O ⇌ 2Al(OH)3 + 3H2SO4
Quá trình thủy phân làm dung dịch có tính axit do tạo ra H2SO4. Phản ứng thủy phân có thể đảo ngược và phụ thuộc vào nhiệt độ.

Trong thực tế giảng dạy, tôi thường nhấn mạnh với học sinh rằng phản ứng thủy phân là nguyên nhân khiến dung dịch nhôm sunfat có môi trường axit.
Ứng dụng của nhôm sunfat trong đời sống và công nghiệp
Nhôm sunfat ứng dụng rộng rãi trong nhiều lĩnh vực khác nhau. Hợp chất này có tính chất đặc biệt giúp kết tủa các chất bẩn và loại bỏ tạp chất hiệu quả. Để hiểu rõ hơn về cách sử dụng công thức của phèn nhôm, chúng ta sẽ tìm hiểu các ứng dụng cụ thể.

Ứng dụng trong xử lý nước
Nhôm sunfat đóng vai trò quan trọng trong quá trình làm sạch nước. Khi hòa tan vào nước, nó tạo thành kết tủa Al(OH)3 có khả năng hấp phụ tốt.
Tôi thường giải thích cho học sinh bằng thí nghiệm đơn giản: cho một ít phèn chua vào cốc nước đục. Sau vài phút, các chất bẩn lơ lửng sẽ kết tủa và lắng xuống đáy.
Trong các nhà máy xử lý nước, nhôm sunfat được sử dụng với liều lượng từ 10-50mg/L tùy theo độ đục của nước thô.
Ứng dụng trong công nghiệp giấy
Trong sản xuất giấy, nhôm sunfat giúp tăng độ bền và chất lượng sản phẩm. Hợp chất này tạo lớp phủ bảo vệ trên bề mặt giấy.
Kinh nghiệm 20 năm giảng dạy cho thấy học sinh dễ nhớ công dụng này khi liên hệ với công thức natri sunfat là gì. Cả hai đều là muối sunfat nhưng có tính chất khác nhau.
Nhà máy giấy thường bổ sung 1-2% nhôm sunfat vào bột giấy để cải thiện độ trắng và độ bền của sản phẩm.
Ứng dụng trong nông nghiệp
Nhôm sunfat được sử dụng để điều chỉnh độ pH của đất. Nó giúp cải tạo đất kiềm thành đất trung tính phù hợp với nhiều loại cây trồng.
Trong phòng thí nghiệm trường học, tôi thường cho học sinh làm thí nghiệm nhỏ giọt dung dịch nhôm sunfat vào đất và đo pH. Điều này giúp các em hiểu rõ hơn về tính chất hóa học.
Nông dân thường sử dụng 2-5kg nhôm sunfat cho 1000m2 đất tùy theo độ kiềm của đất và loại cây trồng.
FAQ: Câu hỏi thường gặp về nhôm sunfat
Các thắc mắc phổ biến về nhôm sunfat thường xoay quanh tính chất, độ độc hại và cách bảo quản an toàn. Tôi sẽ giải đáp chi tiết từng vấn đề để bạn hiểu rõ hơn về hợp chất này.
Nhôm sunfat có độc không?
Nhôm sunfat có độc tính thấp khi tiếp xúc ngoài da. Tuy nhiên, việc nuốt phải có thể gây kích ứng đường tiêu hóa và các triệu chứng khó chịu.
Theo nghiên cứu của Viện Khoa học và Công nghệ Việt Nam, liều gây độc cấp tính LD50 qua đường miệng ở chuột là 6207 mg/kg thể trọng. Con số này cho thấy độc tính của hợp chất ở mức độ nhẹ.
Cách bảo quản nhôm sunfat an toàn
Để bảo quản nhôm sunfat đúng cách, cần đặt trong thùng kín tránh ẩm. Nhiệt độ bảo quản tốt nhất là 15-25°C.
Kinh nghiệm 20 năm giảng dạy cho thấy việc bảo quản trong túi nilon kín hoặc hộp nhựa có nắp đậy sẽ giúp chất không bị vón cục. Nên đặt ở nơi khô ráo, tránh ánh nắng trực tiếp.
Phân biệt nhôm sunfat với các muối sunfat khác
Nhôm sunfat có màu trắng tinh thể, dễ tan trong nước. Điểm khác biệt chính là khi hòa tan tạo dung dịch trong suốt có pH acid nhẹ.
Các muối sunfat khác như đồng sunfat có màu xanh, sắt(II) sunfat có màu xanh lục. Khi cho vào dung dịch BaCl2, tất cả đều tạo kết tủa trắng BaSO4.
Một cách đơn giản để nhận biết là cho dung dịch NaOH vào – chỉ có nhôm sunfat tạo kết tủa keo trắng Al(OH)3 tan được trong dư bazơ.
Chất hóa học công thức của nhôm sunfat là Al2(SO4)3 đóng vai trò quan trọng trong nhiều lĩnh vực. Hợp chất này có cấu trúc ion với liên kết bền vững giữa ion nhôm và gốc sunfat. Nhờ tính chất hóa học đa dạng và độ bền cao, nhôm sunfat được ứng dụng rộng rãi trong xử lý nước, sản xuất giấy và nông nghiệp. Việc nắm vững cấu tạo và tính chất của muối này giúp sử dụng hiệu quả và an toàn trong thực tiễn.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

