Công thức sắt 3 oxit và những tính chất quan trọng cần nắm vững
Công thức sắt 3 oxit là kiến thức nền tảng trong chương trình hóa học phổ thông. Hợp chất này tồn tại phổ biến trong tự nhiên dưới dạng quặng hematit. Fe2O3 đóng vai trò quan trọng trong công nghiệp luyện kim và sản xuất sắt thép hiện đại.
Công thức sắt 3 oxit và cấu tạo phân tử
Công thức sắt 3 oxit là Fe2O3, một hợp chất vô cơ phổ biến trong tự nhiên. Đây là oxit sắt có màu nâu đỏ đặc trưng và thường được tìm thấy trong quặng hematit.
Công thức hóa học của sắt 3 oxit là Fe2O3, trong đó Fe có hóa trị III và O có hóa trị II. Mỗi phân tử Fe2O3 gồm 2 nguyên tử sắt liên kết với 3 nguyên tử oxi theo tỉ lệ 2:3.
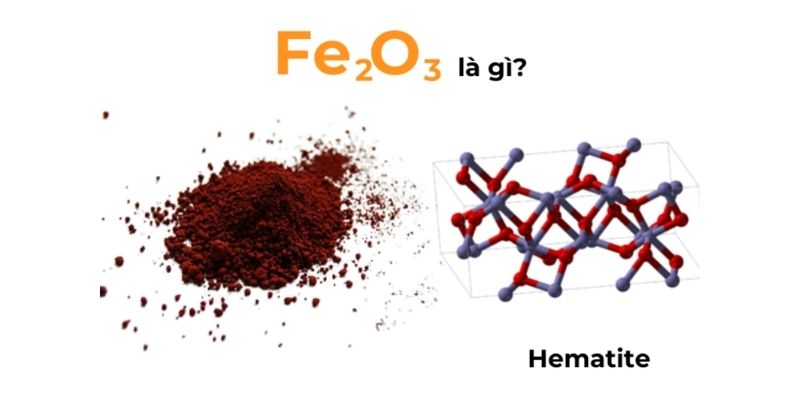
Về cấu tạo phân tử, Fe2O3 có cấu trúc tinh thể dạng lục phương. Các ion Fe3+ và O2- sắp xếp xen kẽ nhau tạo thành mạng tinh thể bền vững.
Trong phòng thí nghiệm, tôi thường cho học sinh quan sát phản ứng:
4Fe + 3O2 → 2Fe2O3
Phản ứng này giúp học sinh dễ dàng nhớ tỉ lệ nguyên tử trong phân tử Fe2O3. Khi nung nóng bột sắt trong không khí, chúng ta sẽ thấy màu nâu đỏ đặc trưng xuất hiện.
Fe2O3 là một trong những oxit sắt quan trọng nhất, được ứng dụng rộng rãi trong công nghiệp sản xuất sắt thép và làm chất màu vô cơ. Tôi thường lấy ví dụ về màu gỉ sắt để minh họa sự có mặt của Fe2O3 trong cuộc sống hàng ngày.
Cách viết và biểu diễn công thức sắt 3 oxit trong hóa học
Sắt 3 oxit là hợp chất phổ biến của sắt và oxi. Cách viết công thức sắt 3 oxit chuẩn trong hóa học là Fe2O3. Đây là một hợp chất quan trọng được sử dụng rộng rãi trong công nghiệp.
Trong quá trình giảng dạy, tôi thường giải thích cho học sinh rằng Fe2O3 có màu nâu đỏ đặc trưng. Màu sắc này giúp phân biệt nó với các oxit sắt khác như công thức của oxit sắt từ Fe3O4 có màu đen.
Quy tắc viết công thức Fe2O3
Fe2O3 được viết theo quy tắc kim loại đứng trước, phi kim đứng sau. Trong đó:
- Fe: Nguyên tử sắt với hóa trị III
- O: Nguyên tử oxi với hóa trị II
- Chỉ số 2 và 3: Số nguyên tử của mỗi nguyên tố
Để nhớ công thức này dễ dàng, tôi thường hướng dẫn học sinh áp dụng phương pháp chéo. Hóa trị III của Fe nhân với 2, hóa trị II của O nhân với 3 sẽ cho kết quả bằng nhau.
Các dạng biểu diễn khác của sắt 3 oxit
Công thức hóa học của sắt 3 oxit có thể được biểu diễn dưới nhiều dạng khác nhau. Trong đó phổ biến nhất là dạng phân tử Fe2O3 và dạng oxit sắt (III).
Trong thực tế giảng dạy, tôi thường nhấn mạnh với học sinh rằng Fe2O3 còn có thể viết dưới dạng Fe3+2O2-3. Cách viết này thể hiện rõ điện tích của các ion trong phân tử.
Ngoài ra, Fe2O3 còn tồn tại ở dạng tinh thể α-Fe2O3 (hematit) và γ-Fe2O3 (maghemit). Mỗi dạng có cấu trúc tinh thể và tính chất vật lý khác nhau.
Tính chất vật lý và hóa học của sắt 3 oxit
Sắt 3 oxit (Fe2O3) là một hợp chất vô cơ quan trọng trong công nghiệp và đời sống. Hợp chất này có nhiều tính chất đặc trưng cần được tìm hiểu kỹ lưỡng.
Trong quá trình giảng dạy, tôi thường giúp học sinh ghi nhớ các tính chất của sắt 3 oxit thông qua việc liên hệ với những vật dụng quen thuộc như gỉ sắt màu nâu đỏ.
Màu sắc và trạng thái
Fe2O3 là chất rắn dạng bột mịn có màu nâu đỏ đặc trưng. Màu sắc này giúp phân biệt với các oxit sắt khác như FeO màu đen.
Khi quan sát dưới kính hiển vi, các hạt Fe2O3 có cấu trúc tinh thể hình thoi. Đây là đặc điểm giúp nhận biết sắt 3 oxit màu gì một cách chính xác.
Độ tan trong nước và dung môi
Sắt 3 oxit có tan trong nước không? Câu trả lời là không. Fe2O3 không tan trong nước lạnh và nước nóng.
Fe2O3 tan được trong axit đặc nóng tạo thành muối sắt (III). Tương tự như sắt II hidroxit là gì, Fe2O3 cũng không tan trong dung dịch kiềm.
Phản ứng hóa học đặc trưng
Fe2O3 tham gia phản ứng với CO ở nhiệt độ cao tạo thành Fe và CO2. Đây là phản ứng quan trọng trong luyện kim.

Fe2O3 phản ứng với axit tạo muối Fe3+ và nước, tương tự như công thức của sắt 3 hiđroxit. Phản ứng này thường được sử dụng trong phòng thí nghiệm.
Khi bị nung nóng đến 1500°C, Fe2O3 phân hủy thành Fe3O4 và O2. Phản ứng này có ý nghĩa trong công nghiệp luyện kim.
Ứng dụng và vai trò của sắt 3 oxit trong đời sống
Sắt 3 oxit có công dụng gì trong cuộc sống? Đây là hợp chất vô cơ với công thức sắt 3 oxit Fe2O3, có màu nâu đỏ đặc trưng và nhiều ứng dụng quan trọng. Tôi sẽ phân tích chi tiết các ứng dụng chính của hợp chất này trong các lĩnh vực.
Công nghiệp và sản xuất
Trong công nghiệp, Fe2O3 đóng vai trò then chốt như một nguyên liệu sản xuất sắt thép. Quá trình này thường kết hợp với công thức sắt 2 sunfat để tạo ra sắt kim loại tinh khiết.
Fe2O3 còn được sử dụng làm chất màu trong sơn chống gỉ và sơn trang trí. Màu nâu đỏ tự nhiên của nó tạo nên lớp phủ bền đẹp, chống ăn mòn hiệu quả cho các công trình.
Trong ngành gốm sứ, Fe2O3 giúp tạo men màu nâu đỏ đặc trưng. Các nghệ nhân thường điều chỉnh tỷ lệ Fe2O3 để có được màu sắc như ý muốn.
Y học và mỹ phẩm
Fe2O3 được ứng dụng rộng rãi trong ngành dược phẩm như một nguồn bổ sung sắt cho cơ thể. Các viên sắt bổ sung thường chứa Fe2O3 dưới dạng vi hạt dễ hấp thu.
Trong mỹ phẩm, Fe2O3 là thành phần tạo màu an toàn cho son môi và phấn má hồng. Kích thước hạt siêu nhỏ giúp sản phẩm mịn màng, bám tốt trên da.
Các loại kem chống nắng cũng thường chứa Fe2O3 nano để tăng khả năng chống tia UV. Hạt Fe2O3 kích thước nano có khả năng phản xạ và hấp thụ tia UV hiệu quả.
FAQ: Câu hỏi thường gặp về sắt 3 oxit
Sắt 3 oxit là hợp chất phổ biến trong tự nhiên và công nghiệp. Tôi sẽ giải đáp các thắc mắc quan trọng về hợp chất này.
Sắt 3 oxit có độc không?
Sắt 3 oxit có độc không là câu hỏi tôi thường nhận được từ học sinh. Câu trả lời là không.
Sắt 3 oxit là hợp chất an toàn, được FDA chấp thuận sử dụng trong mỹ phẩm và thực phẩm với vai trò là chất tạo màu.
Trong 20 năm giảng dạy, tôi thường cho học sinh thí nghiệm trực tiếp với sắt 3 oxit mà không cần trang bị bảo hộ đặc biệt.
Mối liên hệ giữa sắt 3 oxit và gỉ sắt
Sắt 3 oxit có phải là gỉ sắt không? Câu trả lời là có, gỉ sắt chính là sắt 3 oxit hydrat (Fe2O3.nH2O).
Quá trình tạo gỉ sắt liên quan mật thiết đến Công thức hóa học của sắt 3 clorua khi ion clorua xúc tác cho quá trình ăn mòn.
Trong môi trường ẩm ướt, sắt kim loại bị oxi hóa thành sắt 3 oxit màu nâu đỏ đặc trưng mà ta thường thấy trên các vật dụng bằng sắt.
Kiến thức về công thức sắt 3 oxit là nền tảng quan trọng trong chương trình hóa học phổ thông. Hợp chất này có cấu tạo đơn giản nhưng đóng vai trò thiết yếu trong công nghiệp luyện kim và sản xuất. Fe2O3 tồn tại phổ biến trong tự nhiên dưới dạng quặng hematit đỏ nâu và là thành phần chính của gỉ sắt. Việc nắm vững cấu tạo và tính chất của sắt (III) oxit giúp học sinh hiểu sâu hơn về phản ứng oxi hóa khử trong hóa học vô cơ.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

