Thông tin về công thức cấu tạo H2SO4 và tính chất hóa học cơ bản
Công thức cấu tạo H2SO4 là nền tảng để hiểu về axit sunfuric. Phân tử này có cấu trúc không gian đặc biệt với liên kết đơn và đôi. Các tính chất vật lý, hóa học của H2SO4 phụ thuộc vào nồng độ dung dịch. H2SO4 tham gia nhiều phản ứng quan trọng trong phòng thí nghiệm và công nghiệp.
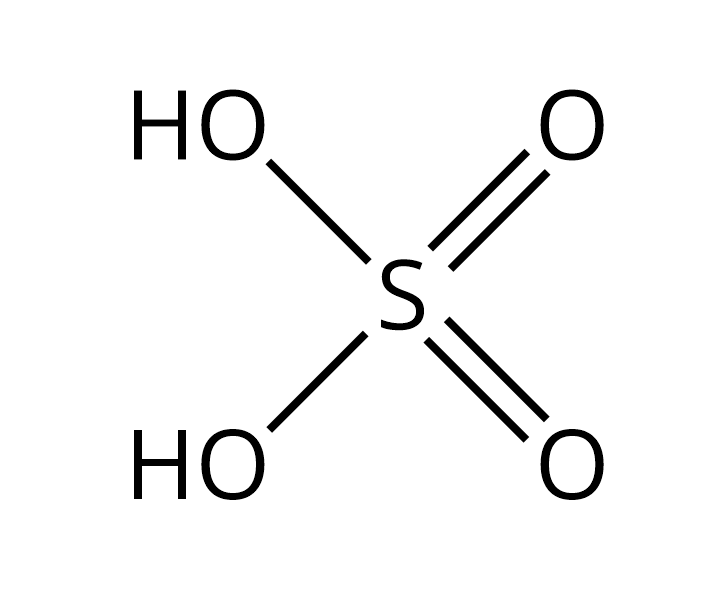
Công thức cấu tạo H2SO4
Axit sunfuric H2SO4 là một trong những axit vô cơ quan trọng nhất trong công nghiệp hóa chất. Tôi sẽ giúp các em hiểu rõ về công thức cấu tạo H2SO4.
Phân tử H2SO4 có cấu tạo gồm nguyên tử S ở trung tâm liên kết với 4 nguyên tử O và 2 nguyên tử H:
H-O-S(=O)2-O-H
Trong đó:
- Nguyên tử S có hóa trị VI, liên kết với 4 nguyên tử O
- Hai nguyên tử O tạo liên kết đôi với S (S=O)
- Hai nguyên tử O còn lại tạo liên kết đơn với S và H (H-O-S)
Khi giảng dạy, tôi thường ví von cấu trúc này như một “cây dù” với nguyên tử S là trụ chính, 4 nguyên tử O như các cạnh dù và 2 nguyên tử H như tay cầm. Cách hình dung này giúp học sinh nhớ lâu hơn.
Một điều quan trọng cần lưu ý là góc liên kết O-S-O xấp xỉ 109°28′, tạo thành cấu trúc tứ diện đều. Đây là cấu trúc bền vững nhất về mặt không gian của phân tử H2SO4.
Hiểu rõ cấu trúc này sẽ giúp các em dễ dàng giải thích được tính chất hóa học của axit sunfuric như khả năng phân ly proton hay tính oxi hóa mạnh của nó.
Cấu tạo phân tử H2SO4 và các liên kết hóa học
Cấu tạo phân tử H2SO4 là một cấu trúc phức tạp với nguyên tử S ở trung tâm. Nguyên tử S liên kết với 4 nguyên tử O và 2 nguyên tử H tạo thành dạng tứ diện.
Phân tử axit sunfuric có cấu trúc đặc biệt tương tự như liên kết trong CH4. Tuy nhiên, các liên kết trong H2SO4 phức tạp hơn do có sự xuất hiện của công thức liên kết hidro.
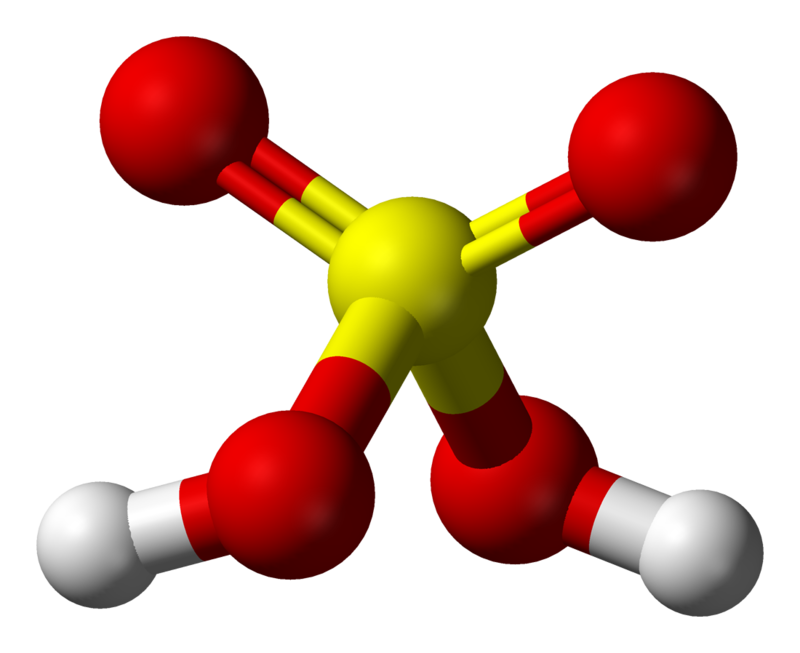
Cấu tạo không gian của phân tử H2SO4
Trong không gian 3 chiều, phân tử H2SO4 có dạng tứ diện méo. Nguyên tử S nằm ở tâm tứ diện, bốn nguyên tử O ở bốn đỉnh.
Hai nguyên tử H liên kết với hai nguyên tử O tạo thành hai nhóm -OH. Hai nguyên tử O còn lại tạo liên kết đôi với nguyên tử S trung tâm.
Các liên kết trong phân tử H2SO4
Phân tử H2SO4 có hai loại liên kết chính:
- Liên kết đơn S-O: Liên kết giữa S và O trong nhóm -OH
- Liên kết đôi S=O: Liên kết giữa S và hai O còn lại
Các liên kết này có độ bền khác nhau do sự phân cực của phân tử. Công thức cấu tạo của H2SO4 thể hiện rõ các liên kết này.
Độ dài liên kết và góc liên kết
Độ dài liên kết S-O đơn khoảng 157pm, liên kết S=O đôi khoảng 142pm. Góc liên kết O-S-O xấp xỉ 109°28′.
Các góc liên kết có sự biến dạng nhẹ so với góc tứ diện lý tưởng. Nguyên nhân là do lực đẩy giữa các cặp electron không liên kết.
Sự khác biệt về độ dài và góc liên kết ảnh hưởng trực tiếp đến tính chất hóa học của axit sunfuric.
Tính chất vật lý và hóa học của axit sunfuric
Axit sunfuric là một trong những axit vô cơ phổ biến nhất trong công nghiệp hóa chất. Tính chất H2SO4 thể hiện rõ qua hai dạng tồn tại chính là dạng đặc và loãng.
Ở nhiệt độ thường, H2SO4 là chất lỏng không màu, có tỷ trọng 1,84 g/ml. Khi tiếp xúc với không khí, axit này hút ẩm mạnh và tỏa nhiều nhiệt.
H2SO4 đặc và loãng
H2SO4 đặc hay loãng phụ thuộc vào nồng độ của dung dịch. H2SO4 đặc có nồng độ 98% và màu nâu sẫm do chứa tạp chất.
H2SO4 loãng có nồng độ thấp hơn, thường dưới 60%. Dung dịch trong suốt và ít nhớt hơn dạng đặc.
Khi pha loãng H2SO4 đặc, cần đổ từ từ axit vào nước và khuấy đều. Không được đổ nước vào axit vì phản ứng tỏa nhiệt mạnh gây bắn axit nguy hiểm.
Tính axit mạnh của H2SO4
H2SO4 là axit 2 nấc, phân ly theo phương trình:
H2SO4 → H+ + HSO4-
HSO4- → H+ + SO42-
Nấc thứ nhất phân ly hoàn toàn nên H2SO4 là axit mạnh. Nấc thứ hai phân ly yếu hơn nhiều.
H2SO4 phản ứng được với nhiều kim loại, oxit bazơ và muối. Đặc biệt với công thức cấu tạo của so2 tạo thành muối sunfat.
Tính oxi hóa của H2SO4 đặc
H2SO4 đặc là chất oxi hóa mạnh do có công thức cấu tạo của so3. Nó oxi hóa được nhiều kim loại thành muối sunfat.
Với kim loại hoạt động như Zn, Fe tạo ra SO2:
Zn + 2H2SO4 (đặc) → ZnSO4 + SO2↑ + 2H2O
Với kim loại kém hoạt động như Cu, Ag tạo ra SO2:
Cu + 2H2SO4 (đặc) → CuSO4 + SO2↑ + 2H2O
Tính oxi hóa mạnh của H2SO4 đặc còn thể hiện qua khả năng làm than hóa các chất hữu cơ như đường, giấy.
Phản ứng của H2SO4 với các chất
Axit sunfuric là một trong những axit mạnh phổ biến nhất trong công nghiệp và phòng thí nghiệm. Nó tham gia nhiều phản ứng hóa học quan trọng với kim loại, bazơ và muối.
H2SO4 tác dụng với kim loại
H2SO4 tác dụng với kim loại tạo ra muối sunfat và giải phóng khí hydro. Phản ứng này xảy ra với dung dịch H2SO4 loãng.
H2SO4 + Fe → FeSO4 + H2↑
Với H2SO4 đặc và nóng, phản ứng sẽ tạo ra SO2 thay vì H2. Tôi thường nhắc học sinh ghi nhớ quy luật này qua ví dụ thực tế về việc rơi vãi axit lên bề mặt kim loại.
Cu + 2H2SO4 (đặc) → CuSO4 + SO2↑ + 2H2O
H2SO4 tác dụng với bazơ và oxit bazơ
H2SO4 tác dụng với bazơ và oxit bazơ là phản ứng trung hòa điển hình. Tương tự như công thức cấu tạo h2co3, sản phẩm tạo thành là muối và nước.
H2SO4 + 2NaOH → Na2SO4 + 2H2O
H2SO4 + CuO → CuSO4 + H2O
Phản ứng này thường được ứng dụng trong sản xuất phân bón và các hợp chất vô cơ khác.
H2SO4 tác dụng với muối
H2SO4 tác dụng với muối thường xảy ra khi H2SO4 đặc và nóng. Giống như công thức cấu tạo h2o2, phản ứng này tạo ra axit mới và muối mới.
2NaCl + H2SO4 (đặc) → Na2SO4 + 2HCl↑
Trong phòng thí nghiệm, tôi thường sử dụng phản ứng này để điều chế các axit bay hơi như HCl, HNO3.
NaNO3 + H2SO4 → NaHSO4 + HNO3↑
FAQ: Câu hỏi thường gặp về H2SO4
Axit sunfuric là một trong những hóa chất quan trọng nhất trong công nghiệp hóa chất. Công thức H2SO4 là gì và cách sử dụng an toàn luôn là mối quan tâm hàng đầu. H2SO4 công thức cấu tạo có cấu trúc phân tử gồm 2 nguyên tử H, 1 nguyên tử S và 4 nguyên tử O.
H2SO4 có những ứng dụng gì trong thực tế?
Axit sunfuric được ứng dụng rộng rãi trong sản xuất phân bón. Hợp chất này tham gia phản ứng với công thức cấu tạo n2h4 tạo thành phân đạm.
Trong công nghiệp luyện kim, H2SO4 được dùng để tẩy rửa kim loại. Quá trình này tương tự phản ứng của công thức cấu tạo của hno2 với kim loại.
Ngành dệt may sử dụng axit sunfuric để xử lý vải sợi. Chất này còn được dùng trong sản xuất công thức cấu tạo của nh4cl và nhiều hợp chất khác.
Tại sao không được đổ nước vào H2SO4 đặc?
Khi đổ nước vào H2SO4 đặc sẽ tạo ra phản ứng tỏa nhiệt mạnh. Nhiệt độ có thể lên tới 100°C khiến dung dịch bắn tung tóe gây bỏng nặng.
Phản ứng này còn tạo ra các giọt axit nhỏ li ti bay trong không khí. Việc hít phải các giọt axit này sẽ gây tổn thương đường hô hấp nghiêm trọng.
Làm thế nào để pha loãng H2SO4 đúng cách?
Bước 1: Chuẩn bị bình thủy tinh chịu nhiệt sạch và khô. Đổ sẵn lượng nước cất cần thiết vào bình.
Bước 2: Dùng pipet nhỏ từng giọt H2SO4 đặc vào nước. Vừa nhỏ vừa khuấy đều để tránh tích tụ nhiệt cục bộ.
Bước 3: Đợi dung dịch nguội hoàn toàn mới đậy nắp và bảo quản. Luôn ghi nhãn rõ ràng nồng độ dung dịch sau khi pha loãng.
Kiến thức về công thức cấu tạo H2SO4 giúp học sinh nắm vững cấu trúc phân tử và các liên kết hóa học của axit sunfuric. Phân tử H2SO4 có cấu trúc tứ diện với nguyên tử S ở trung tâm và các liên kết đặc trưng. Tính chất vật lý, hóa học cùng các phản ứng với kim loại, bazơ, muối của H2SO4 đều xuất phát từ đặc điểm cấu tạo này. Đây là kiến thức nền tảng để học sinh vận dụng trong học tập và thực hành an toàn với axit sunfuric.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

