Nghiên cứu công thức hóa học của axit sunfuric H2SO4 và ứng dụng
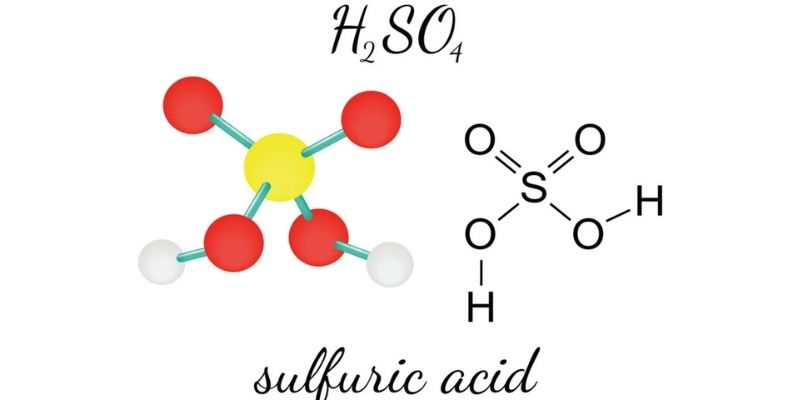
Công thức hóa học của axit sunfuric H2SO4 là nền tảng quan trọng trong ngành công nghiệp hóa chất. Phân tử này có cấu trúc đặc biệt với hai nguyên tử hydro và một nguyên tử lưu huỳnh. Các tính chất vật lý, hóa học độc đáo giúp nó trở thành “nữ hoàng” trong các phản ứng hóa học.
Công thức hóa học của axit sunfuric
Công thức hóa học của axit sunfuric là H2SO4. Đây là một trong những axit vô cơ phổ biến nhất trong công nghiệp hóa chất.
Công thức cấu tạo của H2SO4 gồm:
- 2 nguyên tử Hydro (H)
- 1 nguyên tử Lưu huỳnh (S)
- 4 nguyên tử Oxi (O)
Trong phân tử H2SO4, các nguyên tử liên kết với nhau theo cấu trúc:
H-O-S(=O)2-O-H
Qua 20 năm giảng dạy, tôi thường giúp học sinh ghi nhớ công thức này bằng cách chia thành 3 phần:
- <h2>2 nguyên tử hydro</h2>- S: 1 nguyên tử lưu huỳnh
- O4: 4 nguyên tử oxi
Axit sunfuric là một chất lỏng không màu, có tính axit mạnh. Nó có khả năng hút ẩm mạnh và phản ứng mãnh liệt với nước.
Khi pha loãng H2SO4 với nước, cần tuân thủ nguyên tắc: Đổ từ từ axit vào nước và khuấy đều, tuyệt đối không được đổ nước vào axit.
Cấu tạo và đặc điểm phân tử của H2SO4
Axit sunfuric có công thức H2SO4 là một trong những axit vô cơ phổ biến nhất. Phân tử này có cấu trúc đặc biệt và tính chất hóa học đa dạng, tương tự như công thức của axit photphoric.
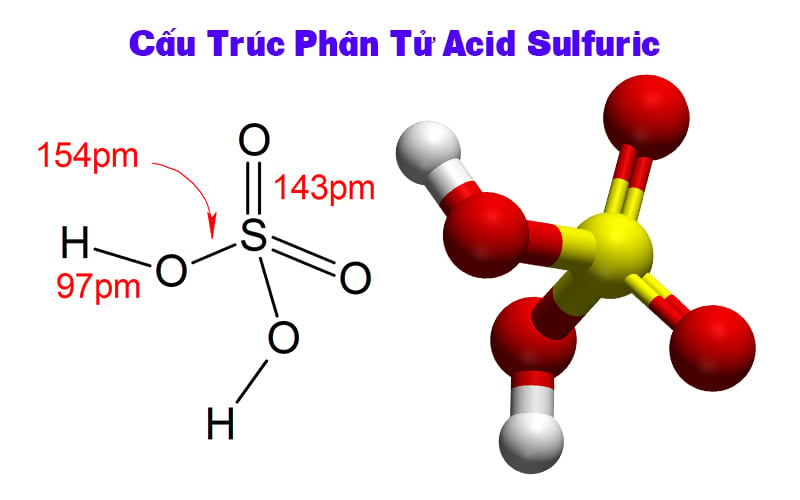
Cấu trúc phân tử H2SO4
Phân tử H2SO4 có dạng tứ diện với nguyên tử S ở trung tâm. Nguyên tử S liên kết với 4 nguyên tử O xung quanh theo hình tứ diện đều.
Hai nguyên tử O tham gia liên kết đôi với S, tạo thành nhóm SO2. Hai nguyên tử O còn lại liên kết đơn với S và mang theo nguyên tử H.
Góc liên kết O-S-O xấp xỉ 109.5°, phù hợp với cấu trúc tứ diện. Độ dài liên kết S=O ngắn hơn S-O do liên kết đôi.
Liên kết hóa học trong phân tử
Trong phân tử công thức hoá học của axit sunfuric, liên kết S-O mang tính chất cộng hóa trị phân cực. Điện tử chuyển dịch từ S về phía O do độ âm điện của O lớn hơn.
Liên kết O-H có tính phân cực mạnh, với H mang điện tích dương và O mang điện tích âm. Đây là cơ sở cho khả năng phân ly proton H+ trong dung dịch.
Các liên kết đôi S=O làm tăng độ bền của phân tử nhờ sự chồng chập orbital p của O và d của S.
Độ phân ly và tính axit mạnh
H2SO4 là axit mạnh với độ phân ly gần như hoàn toàn ở nồng độ thấp. Phân tử phân ly theo hai bậc:
H2SO4 → H+ + HSO4- (bậc 1, phân ly hoàn toàn)
HSO4- → H+ + SO42- (bậc 2, phân ly một phần)
Khả năng phân ly mạnh này là do liên kết O-H phân cực và sự ổn định của ion HSO4- và SO42-. Trong dung dịch loãng, H2SO4 chủ yếu tồn tại dưới dạng ion.
Tính chất vật lý và hóa học của axit sunfuric
Axit sunfuric là một trong những axit vô cơ quan trọng nhất trong công nghiệp hóa chất. Tương tự như công thức hóa học của axit nitric, tính chất axit sunfuric thể hiện rõ qua các đặc điểm vật lý và phản ứng hóa học đặc trưng.
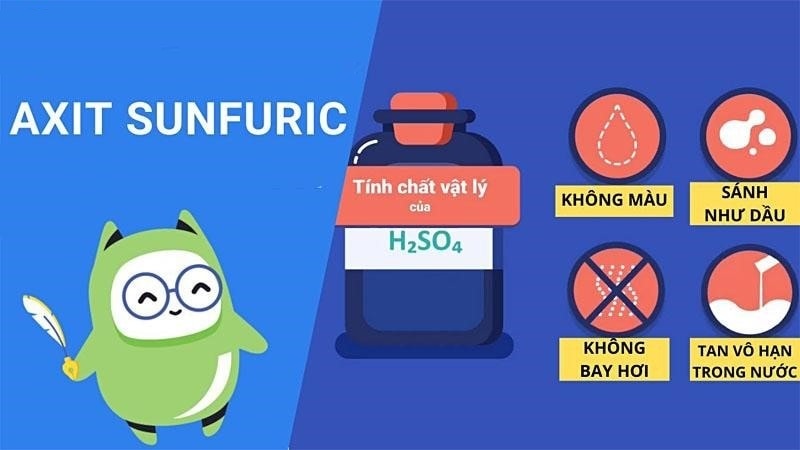
Các tính chất vật lý đặc trưng
Ở nhiệt độ thường, H2SO4 là chất lỏng không màu, có độ nhớt cao. Tôi thường ví von với học sinh rằng nó “sền sệt như dầu ăn” để dễ hình dung.
Axit sunfuric có khối lượng riêng 1,84 g/ml ở 20°C. Điều đặc biệt là khi pha loãng với nước, nhiệt độ tăng rất mạnh và nguy hiểm.
Trong quá trình giảng dạy, tôi luôn nhấn mạnh quy tắc “Acid into water, never the other way around” – nghĩa là luôn rót axit vào nước, không bao giờ làm ngược lại.
Phản ứng với kim loại
Axit sunfuric phản ứng được với hầu hết kim loại đứng trước hydro trong dãy hoạt động. Tùy thuộc vào nồng độ, sản phẩm tạo thành sẽ khác nhau.
Với H2SO4 loãng:
Fe + H2SO4 → FeSO4 + H2↑
Với H2SO4 đặc:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Kinh nghiệm cho thấy học sinh thường nhầm lẫn sản phẩm khí tạo thành. Cần phân biệt rõ: loãng cho H2, đặc cho SO2.
Phản ứng với oxit bazơ và bazơ
Tương tự như công thức hóa học của axit clohiđric, H2SO4 tham gia phản ứng trung hòa điển hình:
CuO + H2SO4 → CuSO4 + H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
Đặc điểm quan trọng là H2SO4 là axit 2 nấc, có thể tạo muối trung hòa hoặc muối axit.
Tính oxi hóa mạnh của H2SO4 đặc
H2SO4 đặc nóng có tính oxi hóa rất mạnh, có thể oxi hóa được cả kim loại trơ như Ag, Cu. Phản ứng thường tạo ra khí SO2:
C + 2H2SO4 → CO2 + 2SO2 + 2H2O
S + 2H2SO4 → 3SO2 + 2H2O
Khi thí nghiệm với H2SO4 đặc, cần hết sức thận trọng vì phản ứng tỏa nhiệt mạnh và sinh ra khí độc SO2.
Ứng dụng quan trọng của axit sunfuric trong đời sống và công nghiệp
Axit sunfuric là một trong những hóa chất công nghiệp quan trọng bậc nhất. Nó được ứng dụng rộng rãi trong nhiều lĩnh vực sản xuất và đời sống.
Với tính chất là axit mạnh và khả năng phản ứng đa dạng, H2SO4 đóng vai trò then chốt trong các ngành công nghiệp hóa chất. Tôi sẽ phân tích chi tiết các ứng dụng chính của axit sunfuric.
Sản xuất phân bón
Trong sản xuất phân bón, H2SO4 là nguyên liệu không thể thiếu. Nó tham gia phản ứng với quặng photphorit để tạo ra phân lân.
Phản ứng chính:
Ca3(PO4)2 + 2H2SO4 → Ca(H2PO4)2 + 2CaSO4
Qua 20 năm giảng dạy, tôi nhận thấy học sinh thường nhầm lẫn về vai trò của nhôm sunfat là gì trong quá trình này. H2SO4 còn dùng để sản xuất phân đạm amoni sunfat (NH4)2SO4.
Điện phân nước
H2SO4 là chất điện ly mạnh nên được dùng làm chất điện phân trong quá trình điện phân nước. Nó giúp tăng độ dẫn điện của dung dịch.
Phản ứng điện phân:
2H2O → 2H2 + O2
Quá trình này tạo ra khí hydro và oxi tinh khiết, phục vụ nhiều mục đích công nghiệp khác nhau.
Sản xuất thuốc nổ và chất tẩy rửa
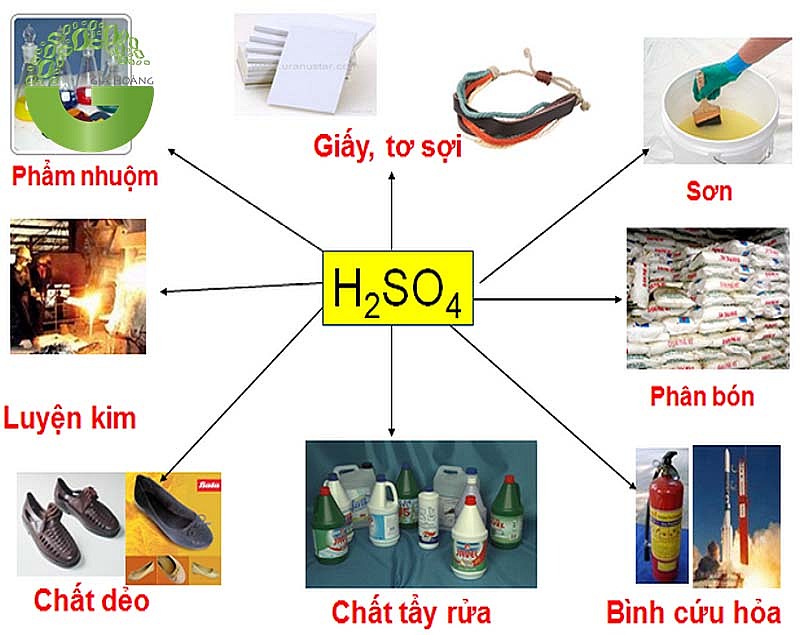
H2SO4 đặc tham gia phản ứng nitro hóa tạo thuốc nổ TNT và nitroglycerin. Đây là phản ứng phức tạp đòi hỏi điều kiện nghiêm ngặt.
Trong công nghiệp chất tẩy rửa, H2SO4 được dùng để sản xuất các chất hoạt động bề mặt. Nó tham gia phản ứng sunfo hóa các hydrocarbon tạo thành các chất tẩy rửa tổng hợp.
Kinh nghiệm của tôi cho thấy việc hiểu rõ cơ chế phản ứng sẽ giúp nắm vững ứng dụng của axit sunfuric trong thực tế.
FAQ: Câu hỏi thường gặp về axit sunfuric
Axit sunfuric là một trong những hóa chất phổ biến được sử dụng rộng rãi trong công nghiệp và phòng thí nghiệm. Tuy nhiên, việc sử dụng axit sunfuric cần tuân thủ nghiêm ngặt các quy tắc an toàn. Tương tự như công thức chung của axit cacboxylic, H2SO4 có tính axit mạnh và độc hại.
Axit sunfuric có độc không?
Axit sunfuric là một chất cực kỳ nguy hiểm, có thể gây bỏng nặng khi tiếp xúc với da. Nó phá hủy các mô sinh học nhanh chóng thông qua phản ứng khử nước mạnh.
Khi hít phải hơi axit sunfuric có thể gây tổn thương nghiêm trọng đến đường hô hấp. Tiếp xúc với mắt sẽ dẫn đến mù lòa vĩnh viễn nếu không được xử lý kịp thời.
Cách pha loãng axit sunfuric an toàn
Nguyên tắc cơ bản khi pha loãng axit sunfuric là “Đổ axit vào nước, cẩn thận sẽ vui”. Không bao giờ đổ nước vào axit vì phản ứng tỏa nhiệt mạnh có thể gây bắn axit.
Quy trình pha loãng cần thực hiện trong tủ hút, đeo đầy đủ bảo hộ. Cho từ từ axit vào nước trong khi khuấy đều liên tục để tản nhiệt.
Tốt nhất nên đặt bình chứa nước trong chậu nước đá để giảm nhiệt độ phản ứng. Luôn chuẩn bị sẵn dung dịch kiềm trung hòa trong trường hợp cần thiết.
Cách bảo quản và sử dụng H2SO4 đúng cách
Axit sunfuric cần được bảo quản trong bình thủy tinh hoặc nhựa chuyên dụng, có nắp đậy kín. Không để gần các chất dễ cháy hoặc kim loại.
Khi sử dụng phải mang găng tay, kính bảo hộ và áo choàng phòng thí nghiệm. Không được hút trực tiếp bằng pipet miệng mà phải dùng quả bóp cao su.
Nơi bảo quản cần khô ráo, thoáng mát và có biển cảnh báo rõ ràng. Kiểm tra định kỳ tình trạng bình chứa để phát hiện rò rỉ hoặc hư hỏng.
Việc nắm vững công thức hóa học của axit sunfuric giúp học sinh hiểu rõ cấu trúc phân tử H2SO4 và các tính chất đặc trưng của nó. Axit sunfuric là một axit mạnh với khả năng oxi hóa cao, được ứng dụng rộng rãi trong sản xuất phân bón và công nghiệp hóa chất. Các phản ứng hóa học của H2SO4 với kim loại, bazơ và oxit bazơ cần được thực hiện theo đúng quy trình an toàn để tránh rủi ro.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

