Thuộc lòng công thức hóa học của quỳ tím và cách nhận biết trong môi trường acid bazơ
Công thức hóa học của quỳ tím đóng vai trò quan trọng trong các phản ứng hóa học. Chất chỉ thị màu này thay đổi sắc tố theo độ pH của môi trường. Quỳ tím giúp phân biệt dung dịch acid và bazơ một cách chính xác trong phòng thí nghiệm.
Công thức hóa học của quỳ tím là gì?
Quỳ tím là một chất chỉ thị màu tự nhiên được chiết xuất từ địa y (rêu đá). Công thức hóa học của quỳ tím khá phức tạp với thành phần chính là azo-litmin (C7H7NO4).
Trong môi trường acid, quỳ tím sẽ chuyển sang màu đỏ do phản ứng:
C7H7NO4 + H+ → C7H8NO4+ (màu đỏ)
Còn trong môi trường bazơ, quỳ tím là chất có màu xanh do phản ứng:
C7H7NO4 + OH- → C7H6NO4- (màu xanh) + H2O
Qua 20 năm giảng dạy, tôi thường ví von quỳ tím như một “cảnh sát giao thông” trong phòng thí nghiệm. Nó giúp phân biệt môi trường acid hay bazơ một cách nhanh chóng và chính xác.

Để dễ nhớ, học sinh có thể ghi nhớ công thức C7H7NO4 thông qua quy tắc: 7-7-4 (như số điện thoại). Trong đó:
- C có 7 nguyên tử
- H có 7 nguyên tử
- O có 4 nguyên tử
- N có 1 nguyên tử
Ngoài ra, quỳ tím còn tồn tại dưới dạng giấy quỳ tím – một dụng cụ đo pH đơn giản và phổ biến trong phòng thí nghiệm hóa học.
Cấu tạo và thành phần hóa học của chất chỉ thị quỳ tím
Quỳ tím công thức hóa học là một hợp chất hữu cơ phức tạp, được chiết xuất từ địa y Roccella tinctoria. Đây là một chất chỉ thị axit-bazơ phổ biến trong phòng thí nghiệm hóa học.
Chất chỉ thị này có màu tím ở pH trung tính, chuyển sang màu đỏ trong môi trường axit và màu xanh trong môi trường bazơ. Sự thay đổi màu sắc này giúp xác định tính chất của dung dịch.
Cấu trúc phân tử của quỳ tím
Phân tử quỳ tím có cấu trúc phức tạp với nhiều vòng thơm liên hợp. Thành phần chính là azolitmin (C7H7NO4), một dẫn xuất của orxin.
Trong phân tử azolitmin tồn tại các liên kết đôi liên hợp, tạo nên hệ thống chromophore – nhóm gây màu đặc trưng. Sự thay đổi cấu trúc của hệ chromophore khi pH thay đổi dẫn đến sự chuyển màu.
Các nhóm chức quan trọng trong phân tử quỳ tím
Phân tử chỉ thị quỳ tím chứa các nhóm chức quyết định tính chất chỉ thị:
- Nhóm hydroxyl (-OH): Có khả năng nhường proton trong môi trường bazơ
- Nhóm imin (=NH): Có thể nhận proton trong môi trường axit
- Nhóm carboxyl (-COOH): Tham gia phản ứng trao đổi proton
Sự tương tác giữa các nhóm chức này với H+ hoặc OH- trong dung dịch tạo nên cơ chế chuyển màu đặc trưng.
Đặc điểm hóa học của quỳ tím
Quỳ tím thể hiện tính chất lưỡng tính, có thể đóng vai trò vừa là axit vừa là bazơ yếu. Trong dải pH từ 5.0 đến 8.0, quỳ tím thay đổi màu sắc rõ rệt.
Khi tôi giảng dạy, tôi thường ví von quỳ tím như một “cảnh sát giao thông” trong phòng thí nghiệm. Nó “phạt đèn đỏ” (màu đỏ) khi gặp axit và “cho đi” (màu xanh) khi gặp bazơ.
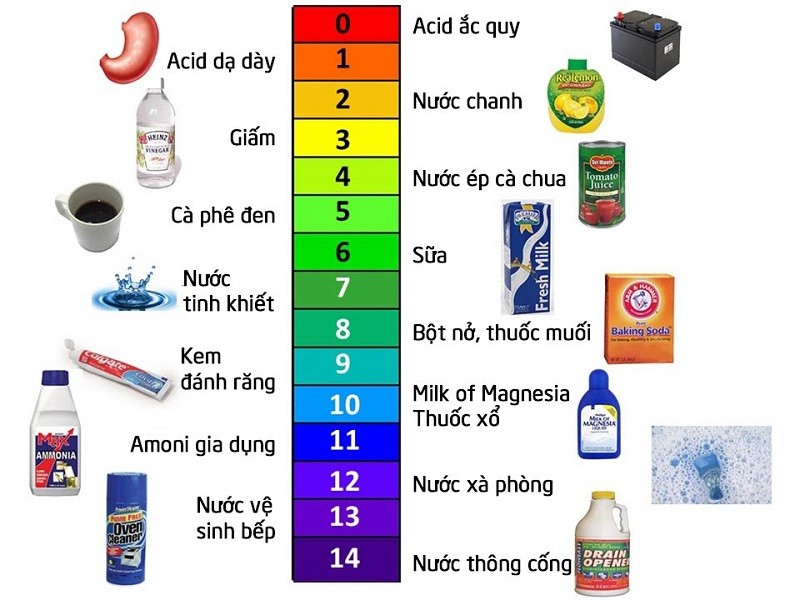
Độ bền của quỳ tím phụ thuộc vào điều kiện bảo quản. Cần tránh ánh sáng mạnh và nhiệt độ cao để duy trì hiệu quả chỉ thị của nó.
Nguyên lý đổi màu của quỳ tím trong môi trường acid và bazơ
Quỳ tím là một chất chỉ thị màu phổ biến trong phòng thí nghiệm hóa học. Chất này có khả năng thay đổi màu sắc khi tiếp xúc với môi trường acid hoặc bazơ.
Nguyên lý cơ bản của quỳ tím đổi màu dựa trên sự thay đổi cấu trúc phân tử khi gặp ion H+ hoặc OH-. Đây là phản ứng thuận nghịch, có thể quay trở về màu ban đầu khi trung hòa.
Cơ chế đổi màu của quỳ tím
Quỳ tím có chứa anthocyanin – một hợp chất hữu cơ phức tạp thuộc nhóm flavonoid. Khi gặp acid, H+ sẽ gắn vào phân tử anthocyanin làm thay đổi cấu trúc electron.
Trong môi trường bazơ, OH- tương tác với anthocyanin tạo thành một phức chất mới. Sự thay đổi cấu trúc phân tử này dẫn đến sự thay đổi về màu sắc.

Màu sắc của quỳ tím trong môi trường acid
Màu quỳ tím trong môi trường acid sẽ chuyển sang màu đỏ. Màu càng đỏ đậm thì độ acid càng mạnh.
Theo kinh nghiệm giảng dạy của tôi, học sinh thường nhớ quy tắc: “Acid đỏ như máu” để ghi nhớ màu quỳ tím trong acid.
Màu sắc của quỳ tím trong môi trường bazơ
Màu quỳ tím trong môi trường bazơ sẽ chuyển thành màu xanh. Độ đậm của màu xanh tỷ lệ thuận với nồng độ bazơ.
Tôi thường ví von với học sinh: “Bazơ xanh như lá” để các em dễ nhớ. Phương pháp này giúp học sinh phân biệt rõ màu sắc trong hai môi trường.
Ứng dụng và cách sử dụng quỳ tím trong thực nghiệm hóa học
Quỳ tím là chất chỉ thị màu phổ biến trong phòng thí nghiệm hóa học. Chất này có khả năng đổi màu khi tiếp xúc với môi trường acid hoặc base.
Trong môi trường acid, quỳ tím trong hóa học chuyển sang màu đỏ. Còn trong môi trường base, quỳ tím sẽ chuyển thành màu xanh.

Cách pha chế dung dịch quỳ tím
Để pha chế dung dịch quỳ tím, cần chuẩn bị bột quỳ tím và nước cất. Công thức hóa học của quỳ tím là một hỗn hợp phức tạp từ thực vật.
Cân 1g bột quỳ tím cho vào cốc thủy tinh. Thêm 100ml nước cất vào và khuấy đều hỗn hợp trong 5-10 phút.
Lọc dung dịch qua giấy lọc để loại bỏ cặn. Thu được dung dịch quỳ tím trong suốt màu tím nhạt.
Cách sử dụng giấy quỳ tím
Giấy quỳ tím được tẩm dung dịch quỳ tím và để khô tự nhiên. Giấy này rất nhạy với độ pH của dung dịch.
Khi nhúng giấy quỳ vào dung dịch cần kiểm tra, đợi 2-3 giây để quan sát sự đổi màu. Màu đỏ chứng tỏ dung dịch có tính acid, màu xanh là base.
Tôi thường hướng dẫn học sinh so sánh màu giấy quỳ với thang màu chuẩn để xác định pH chính xác hơn.
Các ứng dụng phổ biến của quỳ tím
Quỳ tím được sử dụng rộng rãi trong phòng thí nghiệm để kiểm tra tính acid-base của dung dịch. Nó cũng giúp xác định độ pH của đất và nước.
Trong công nghiệp thực phẩm, quỳ tím dùng kiểm tra độ chua của sữa chua, dưa muối. Tương tự như công thức hóa học của thuốc tím, quỳ tím cũng có vai trò quan trọng.
Các phòng thí nghiệm y tế sử dụng quỳ tím để kiểm tra pH nước tiểu, dịch dạ dày phục vụ chẩn đoán bệnh.
FAQ: Câu hỏi thường gặp về quỳ tím
Quỳ tím là chất chỉ thị màu phổ biến trong phòng thí nghiệm hóa học. Tôi sẽ giải đáp các thắc mắc quan trọng về cách bảo quản và sử dụng quỳ tím hiệu quả.
Cách bảo quản quỳ tím đúng cách
Quỳ tím cần được bảo quản trong điều kiện khô ráo, tránh ánh nắng trực tiếp. Nhiệt độ lý tưởng để bảo quản quỳ tím là 15-25°C.
Giấy quỳ tím phải được đặt trong hộp kín có chất hút ẩm silica gel. Điều này giúp giữ độ nhạy của công thức hóa học của quỳ tím không bị suy giảm.
Tôi thường hướng dẫn học sinh đặt hộp đựng quỳ tím trong tủ thuốc thử riêng biệt. Cách này giúp tránh nhiễm bẩn từ các hóa chất khác.
Những lưu ý khi sử dụng quỳ tím
Công dụng quỳ tím chủ yếu là xác định tính axit-bazơ của dung dịch. Khi sử dụng cần tránh chạm tay trực tiếp vào giấy quỳ.
Không nên nhúng cả tờ giấy quỳ vào dung dịch cần thử. Chỉ cần nhúng một phần nhỏ là đủ để quan sát sự đổi màu.
Sau khi sử dụng xong, cần đậy kín hộp đựng quỳ tím ngay lập tức. Việc này ngăn không khí ẩm làm giảm độ nhạy của giấy quỳ.
Cách nhận biết quỳ tím chuẩn
Cách nhận biết quỳ tím chuẩn dựa vào màu sắc và độ đồng đều của giấy quỳ. Giấy quỳ tím chuẩn có màu tím đồng nhất.
Khi nhúng vào dung dịch axit, giấy quỳ tím chuẩn chuyển sang màu đỏ tươi. Trong môi trường bazơ, nó chuyển thành màu xanh đậm.
Tôi thường kiểm tra độ nhạy của quỳ tím bằng dung dịch chuẩn HCl 0,1M và NaOH 0,1M. Quỳ tím chuẩn sẽ đổi màu ngay lập tức khi tiếp xúc.
Việc nắm vững công thức hóa học của quỳ tím giúp học sinh hiểu rõ cơ chế đổi màu của chất chỉ thị này trong môi trường acid và bazơ. Quỳ tím là công cụ quan trọng trong phòng thí nghiệm để xác định tính chất của dung dịch. Các thao tác sử dụng và bảo quản quỳ tím đúng cách đảm bảo độ chính xác cao trong thực nghiệm hóa học. Đây là kiến thức nền tảng cần thiết cho việc học tập và nghiên cứu hóa học.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

