Học công thức aspirin và quy trình tổng hợp chuẩn trong hóa học
Công thức aspirin là một trong những phát minh quan trọng của ngành dược phẩm. Aspirin được tổng hợp từ acid salicylic và anhydric acetic. Quá trình điều chế aspirin đòi hỏi kỹ thuật thực hành chính xác trong phòng thí nghiệm. Các phản ứng hóa học của aspirin thể hiện tính chất đặc trưng của nhóm este.
Công thức aspirin
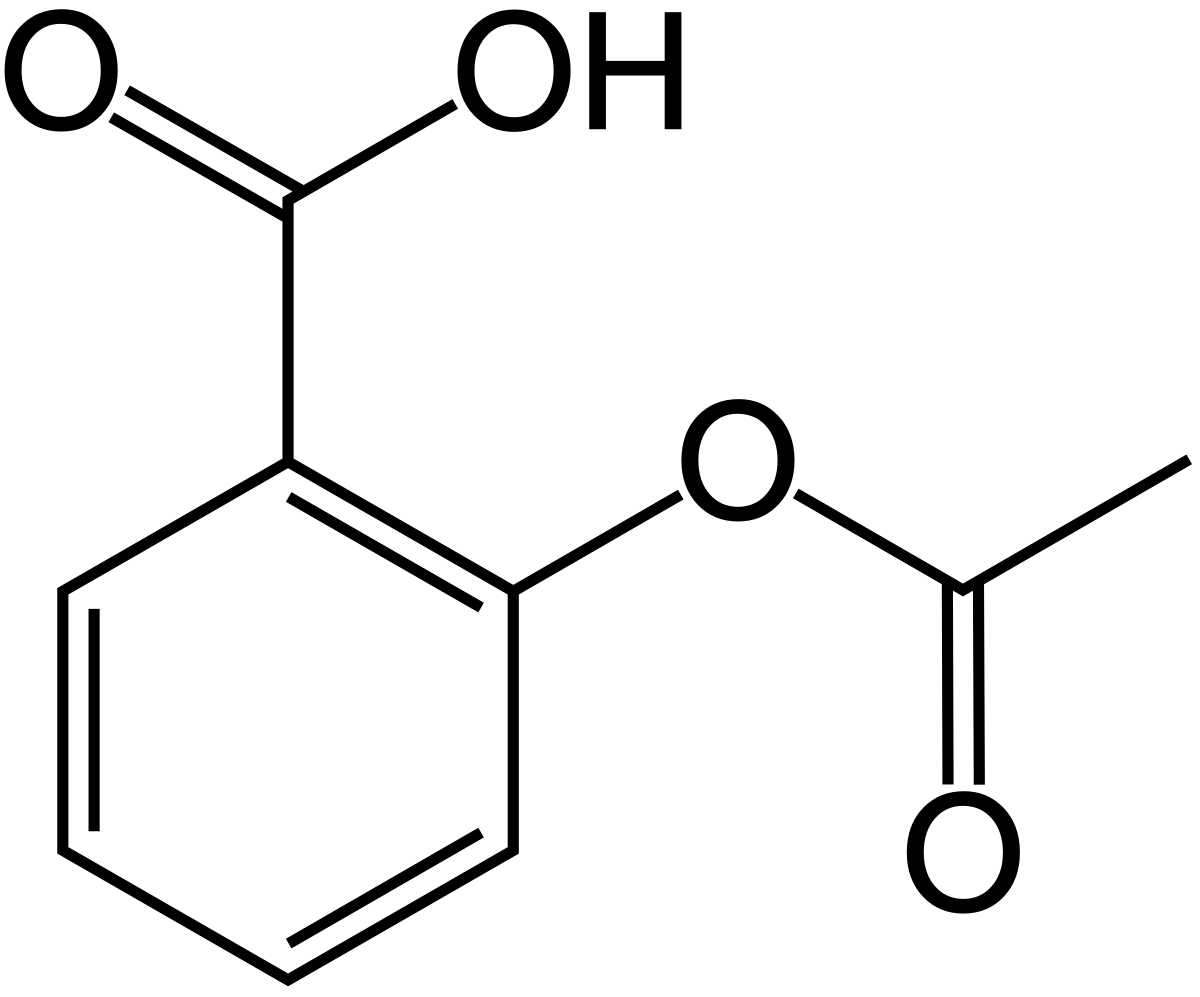
Aspirin là một trong những loại thuốc giảm đau phổ biến nhất thế giới. Công thức aspirin có tên khoa học là acid acetylsalicylic với công thức phân tử C9H8O4.
Công thức cấu tạo của aspirin được biểu diễn như sau:
CH3-CO-O-C6H4-COOH
Trong đó:
- CH3-CO: Nhóm acetyl
- O: Nguyên tử oxy liên kết
- C6<h4>Vòng benzen</h4>- COOH: Nhóm carboxyl
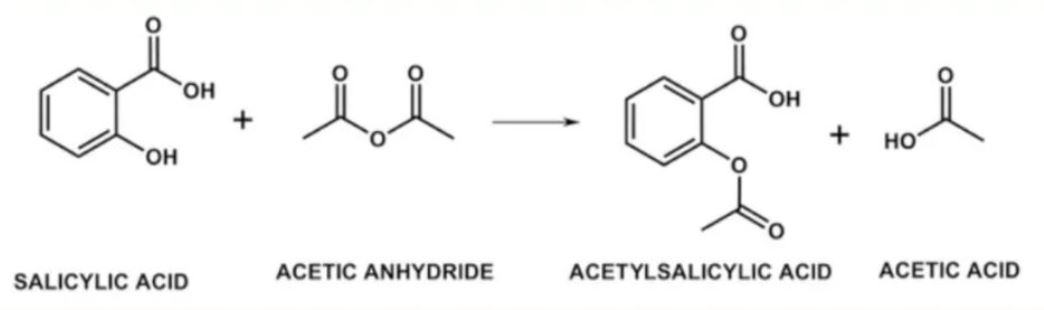
Aspirin được tổng hợp từ phản ứng giữa acid salicylic và anhydrid acetic theo phương trình:
C7H6O3 + (CH3CO)2O → C9H8O4 + CH3COOH
Với kinh nghiệm 20 năm giảng dạy, tôi thường giúp học sinh ghi nhớ công thức này bằng cách chia thành 3 phần: nhóm acetyl – cầu nối oxy – vòng benzen mang nhóm carboxyl. Cách này giúp các em dễ dàng nhớ và viết lại công thức khi làm bài.
Để kiểm tra độ tinh khiết của aspirin, chúng ta có thể dùng phương pháp đo điểm nóng chảy. Aspirin tinh khiết có điểm nóng chảy là 135°C. Đây là một thông số quan trọng mà các em cần nắm vững khi học về hợp chất này.
Cấu tạo phân tử và tính chất hóa học của aspirin
Aspirin là một trong những loại thuốc phổ biến nhất thế giới. Để hiểu rõ cơ chế hoạt động, cần nắm vững cấu tạo và tính chất của nó.
Cấu trúc phân tử aspirin
Aspirin cấu tạo có công thức phân tử là C9H8O4, tên hóa học là acid acetylsalicylic. Phân tử gồm một vòng benzen và hai nhóm chức quan trọng.
Nhóm chức thứ nhất là nhóm carboxyl (-COOH) liên kết trực tiếp với vòng benzen. Nhóm này tạo tính acid cho phân tử.
Nhóm chức thứ hai là nhóm acetyl (-COCH3) gắn với nguyên tử oxy. Đây là nhóm quyết định hoạt tính sinh học của aspirin.
Các tính chất vật lý của aspirin
Aspirin tồn tại ở dạng tinh thể màu trắng, không mùi. Nhiệt độ nóng chảy khoảng 135°C.
Aspirin khó tan trong nước lạnh nhưng tan tốt trong nước nóng. Nó dễ dàng hòa tan trong dung môi hữu cơ như ethanol.
Khi bảo quản, aspirin cần tránh ẩm và nhiệt độ cao. Điều kiện này giúp ngăn sự thủy phân thành acid salicylic.
Tính chất hóa học đặc trưng
Aspirin hóa học thể hiện tính acid yếu do nhóm -COOH. Nó phản ứng được với bazơ tạo muối và nước.
Phản ứng quan trọng nhất là thủy phân trong môi trường acid hoặc bazơ. Sản phẩm tạo thành là acid salicylic và acid acetic.
Tương tự như công thức paracetamol, aspirin có khả năng tham gia phản ứng este hóa và phản ứng thế ở vòng benzen.
Trong cơ thể, aspirin chuyển hóa thành acid salicylic – chất có tác dụng giảm đau và hạ sốt hiệu quả.
Quy trình tổng hợp aspirin trong phòng thí nghiệm
Aspirin là một trong những loại thuốc phổ biến nhất thế giới. Cách tổng hợp aspirin từ acid salicylic và anhydrid acetic là phản ứng este hóa cơ bản.
Để tổng hợp thành công, cần tuân thủ quy trình chặt chẽ và đảm bảo an toàn. Quá trình này tương tự như công thức sorbitol khi đòi hỏi độ tinh khiết cao của sản phẩm.
Nguyên liệu và dụng cụ cần thiết
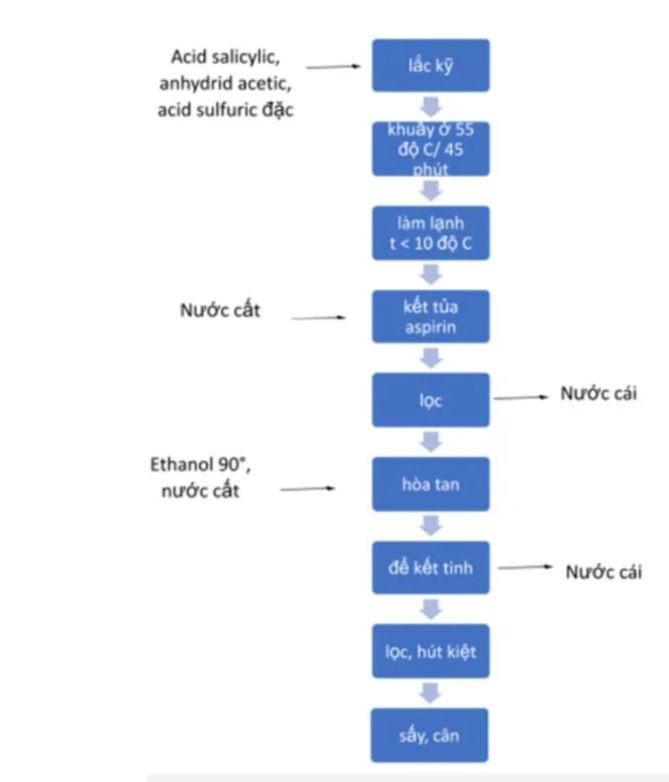
Nguyên liệu chính gồm acid salicylic tinh khiết và anhydrid acetic nguyên chất. Ngoài ra cần có acid sulfuric đặc làm xúc tác và nước cất để tinh chế.
Về dụng cụ thí nghiệm, cần chuẩn bị bình cầu, sinh hàn hồi lưu và nhiệt kế. Phễu lọc, giấy lọc và cốc thủy tinh dùng cho quá trình tinh chế sản phẩm.
Bộ đun cách thủy và đũa thủy tinh giúp kiểm soát nhiệt độ phản ứng. Các dụng cụ bảo hộ như kính, găng tay là không thể thiếu.
Các bước tổng hợp chi tiết
Bước đầu tiên là cho acid salicylic vào bình cầu, thêm từ từ anhydrid acetic. Nhỏ 2-3 giọt acid sulfuric đặc làm xúc tác.
Lắp sinh hàn hồi lưu và đun cách thủy ở 60°C trong 30 phút. Aspirin tổng hợp phòng thí nghiệm sẽ kết tinh khi làm lạnh hỗn hợp.
Lọc lấy tinh thể aspirin và rửa bằng nước lạnh. Sấy khô sản phẩm ở 40-50°C để loại nước và tạp chất bay hơi.
Những lưu ý khi thực hiện
An toàn phòng thí nghiệm là yếu tố quan trọng hàng đầu. Cần mặc áo blouse, đeo kính và găng tay bảo hộ khi làm việc.
Kiểm soát nhiệt độ phản ứng rất quan trọng. Nhiệt độ quá cao sẽ phân hủy sản phẩm, quá thấp làm giảm hiệu suất phản ứng.
Rửa sạch dụng cụ trước và sau thí nghiệm. Thu gom và xử lý chất thải đúng quy định để bảo vệ môi trường.
Sản xuất aspirin trong công nghiệp
Quy trình sản xuất aspirin công nghiệp đòi hỏi sự chính xác và kiểm soát chặt chẽ. Quá trình này cần tuân thủ các tiêu chuẩn GMP nghiêm ngặt để đảm bảo chất lượng sản phẩm.
Quy trình sản xuất công nghiệp
Bước đầu tiên là phản ứng giữa phenol và natri hydroxide tạo natri phenoxide. Sau đó, natri phenoxide phản ứng với carbon dioxide tạo acid salicylic.
Acid salicylic tiếp tục phản ứng với anhydride acetic tạo thành công thức aspirin và acid acetic. Phản ứng diễn ra ở nhiệt độ 85°C trong 2 giờ.
Sản phẩm được kết tinh, ly tâm và sấy khô ở 90°C. Quá trình này giúp loại bỏ tạp chất và đạt độ tinh khiết cao.
Kiểm soát chất lượng sản phẩm
Mỗi mẻ sản xuất đều trải qua kiểm nghiệm về độ tinh khiết. Phương pháp sắc ký lỏng hiệu năng cao xác định hàm lượng hoạt chất.
Các chỉ tiêu quan trọng gồm độ hòa tan, độ rã và độ đồng đều khối lượng. Sản phẩm phải đạt tiêu chuẩn dược điển quốc tế.
Tôi thường nhắc học sinh rằng kiểm soát chất lượng giống như “bác sĩ khám bệnh” cho thuốc. Mỗi viên aspirin đều cần “khám sức khỏe” kỹ lưỡng.
Đóng gói và bảo quản
Aspirin được đóng gói trong vỉ nhôm-PVC kín khí, tránh ẩm. Mỗi vỉ chứa 10-20 viên tùy quy cách.
Sản phẩm cần bảo quản ở nhiệt độ phòng dưới 30°C, tránh ánh sáng trực tiếp. Thời hạn sử dụng thường là 36 tháng kể từ ngày sản xuất.
Kinh nghiệm cho thấy việc bảo quản đúng cách giúp duy trì hiệu lực của thuốc. Tôi luôn nhấn mạnh với sinh viên về tầm quan trọng của khâu này.
Các phản ứng hóa học quan trọng của aspirin
Aspirin phản ứng là một trong những kiến thức quan trọng mà học sinh cần nắm vững. Trong quá trình giảng dạy, tôi thường chia sẻ với học sinh rằng aspirin tham gia vào nhiều phản ứng hóa học đặc trưng.
Aspirin có công thức phân tử C9H8O4, là một acid yếu nên có khả năng tham gia phản ứng với nhiều chất khác nhau. Các phản ứng của aspirin thường được đề cập trong chương trình aspirin hóa học 12.
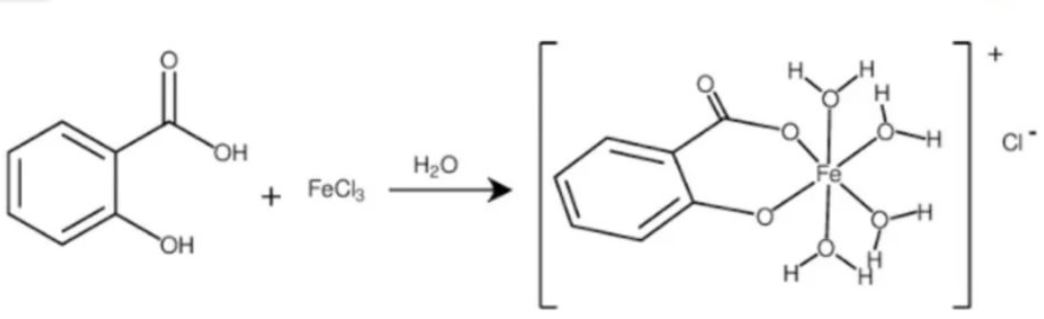
Phản ứng thủy phân
Phản ứng thủy phân của aspirin xảy ra khi có mặt nước và xúc tác acid hoặc bazơ. Sản phẩm tạo thành là acid salicylic và acid acetic.
Công thức phản ứng:
C9H8O4 + H2O → C7H6O3 + CH3COOH
Đây là phản ứng quan trọng giúp giải thích tại sao aspirin cần được bảo quản trong điều kiện khô ráo. Khi tiếp xúc với độ ẩm, aspirin sẽ bị phân hủy và mất tác dụng.
Phản ứng với bazơ
Aspirin phản ứng với bazơ tạo thành muối và nước. Phản ứng này tương tự như công thức dap khi tác dụng với bazơ.
Công thức phản ứng:
C9H8O4 + NaOH → C9H7O4Na + H2O
Phản ứng này có ý nghĩa quan trọng trong việc điều chế các dạng muối aspirin tan tốt trong nước. Muối natri của aspirin được sử dụng làm thuốc tiêm tĩnh mạch.
Các phản ứng khác
Ngoài phản ứng thủy phân và phản ứng với bazơ, aspirin còn tham gia nhiều phản ứng khác như:
Phản ứng với rượu tạo este:
C9H8O4 + R-OH → C9H7O4R + H2O
Phản ứng oxi hóa khử:
C9H8O4 + [O] → C7H6O3 + CH3COOH
Các phản ứng này ít phổ biến hơn nhưng vẫn có ý nghĩa trong nghiên cứu và sản xuất các dẫn xuất của aspirin.
FAQ: Câu hỏi thường gặp về aspirin
Aspirin là một trong những loại thuốc phổ biến nhất thế giới. Tôi thường nhận được nhiều câu hỏi từ học sinh về loại thuốc này. Dưới đây là một số thắc mắc thường gặp và câu trả lời chi tiết.
Aspirin có thể bảo quản được bao lâu?
Thời hạn sử dụng của aspirin thường kéo dài 2-3 năm kể từ ngày sản xuất. Điều này phụ thuộc vào điều kiện bảo quản và nhà sản xuất.
Để kéo dài tuổi thọ của thuốc, cần bảo quản aspirin ở nhiệt độ phòng từ 15-25°C. Tránh để thuốc tiếp xúc với ánh nắng trực tiếp và độ ẩm cao.
Làm thế nào để nhận biết aspirin nguyên chất?
Công thức của aspirin nguyên chất có màu trắng tinh khiết và không mùi. Khi hòa tan trong nước, aspirin nguyên chất sẽ tạo thành dung dịch trong suốt.
Một cách đơn giản để kiểm tra độ tinh khiết là quan sát bề mặt viên thuốc. Aspirin nguyên chất có bề mặt nhẵn, đồng đều và không có vết nứt hay đốm màu.
Tại sao aspirin lại có vị chua?
Công thức aspirin là gì và tại sao nó có vị chua? Aspirin có công thức aspirin điều chế là C9H8O4, thuộc nhóm acid acetylsalicylic.
Vị chua của aspirin đến từ nhóm carboxyl (-COOH) trong cấu trúc phân tử. Khi tiếp xúc với nước bọt, nhóm này giải phóng ion H+ tạo nên vị chua đặc trưng.
Kiến thức về công thức aspirin là nền tảng quan trọng trong chương trình hóa học 12 và hóa dược. Aspirin có cấu trúc phân tử đặc biệt với nhóm chức este và axit cacboxylic, tạo nên những tính chất hóa học độc đáo. Quá trình tổng hợp aspirin trong phòng thí nghiệm và sản xuất công nghiệp đều tuân theo các nguyên tắc cơ bản của phản ứng este hóa. Các phản ứng hóa học của aspirin giúp chúng ta hiểu sâu hơn về bản chất và ứng dụng của hợp chất này trong y học.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

