Thuộc lòng công thức hóa học của kim cương và cấu trúc tinh thể
Công thức hóa học của kim cương là C tinh khiết với cấu trúc mạng tinh thể đặc biệt. Các nguyên tử cacbon liên kết với nhau theo hình tứ diện đều. Cấu trúc này tạo nên độ cứng và độ bền vượt trội của kim cương trong tự nhiên.
Công thức hóa học của kim cương là gì?
Kim cương có công thức hóa học của kim cương là C – cacbon nguyên chất. Đây là dạng tinh thể của cacbon với cấu trúc lập phương tâm mặt.
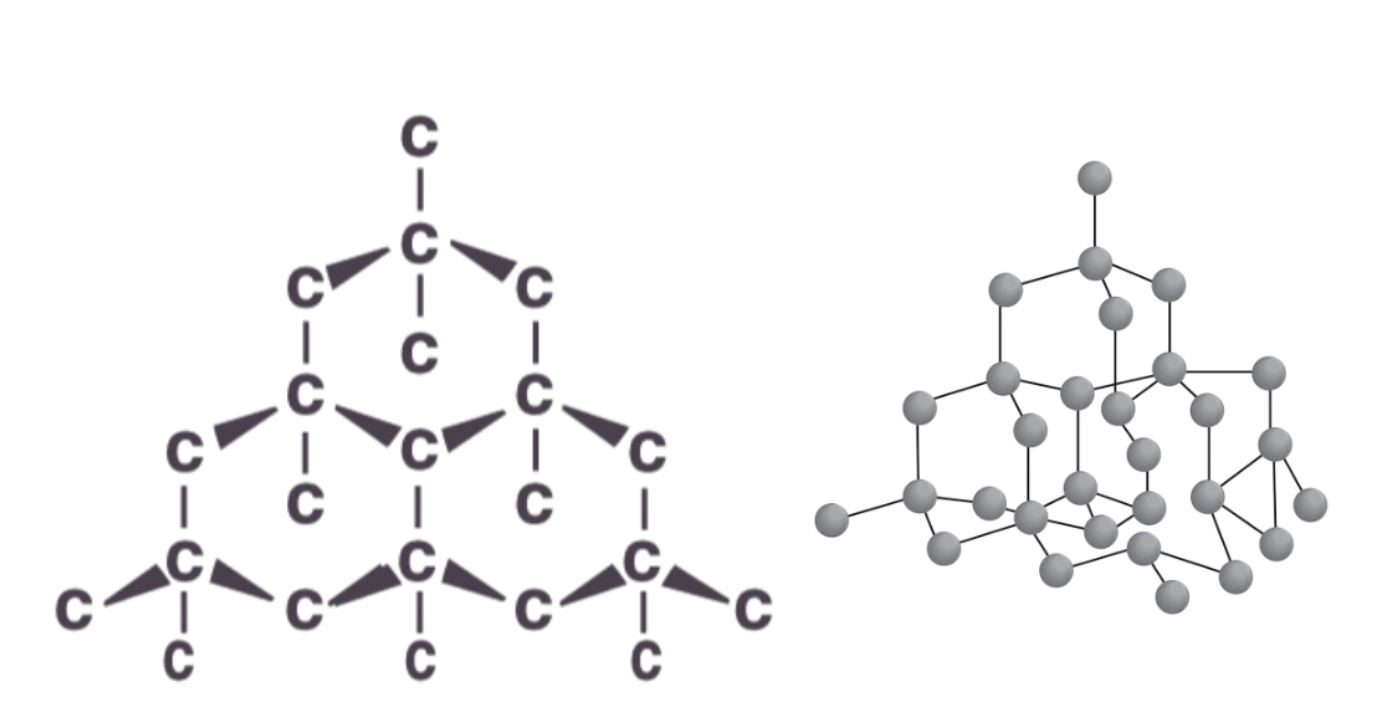
Trong cấu trúc kim cương, mỗi nguyên tử cacbon liên kết với 4 nguyên tử cacbon khác theo dạng tứ diện. Các liên kết này tạo thành góc 109,5° với nhau.
Cấu trúc đặc biệt này tạo nên độ cứng cực cao của kim cương. Thực tế, kim cương đạt 10 điểm trên thang độ cứng Mohs – cao nhất trong tự nhiên.
Khi tôi giảng dạy về cấu trúc kim cương, tôi thường ví von nó như một tòa lâu đài vững chắc. Mỗi nguyên tử cacbon là một viên gạch, được gắn kết chặt chẽ với 4 viên gạch xung quanh.
Một điều thú vị là kim cương và than chì đều có cùng thành phần cacbon. Sự khác biệt nằm ở cách sắp xếp các nguyên tử. Than chì có cấu trúc lớp phẳng, còn kim cương có cấu trúc không gian 3 chiều.
Cấu trúc phân tử và liên kết trong kim cương
Kim cương có cấu trúc phân tử đặc biệt với các nguyên tử carbon liên kết chặt chẽ. Mỗi nguyên tử carbon trong tinh thể kim cương đều liên kết với 4 nguyên tử carbon khác. Sự sắp xếp này tạo nên một mạng tinh thể 3 chiều vô cùng bền vững và đối xứng.
Cấu tạo nguyên tử của kim cương
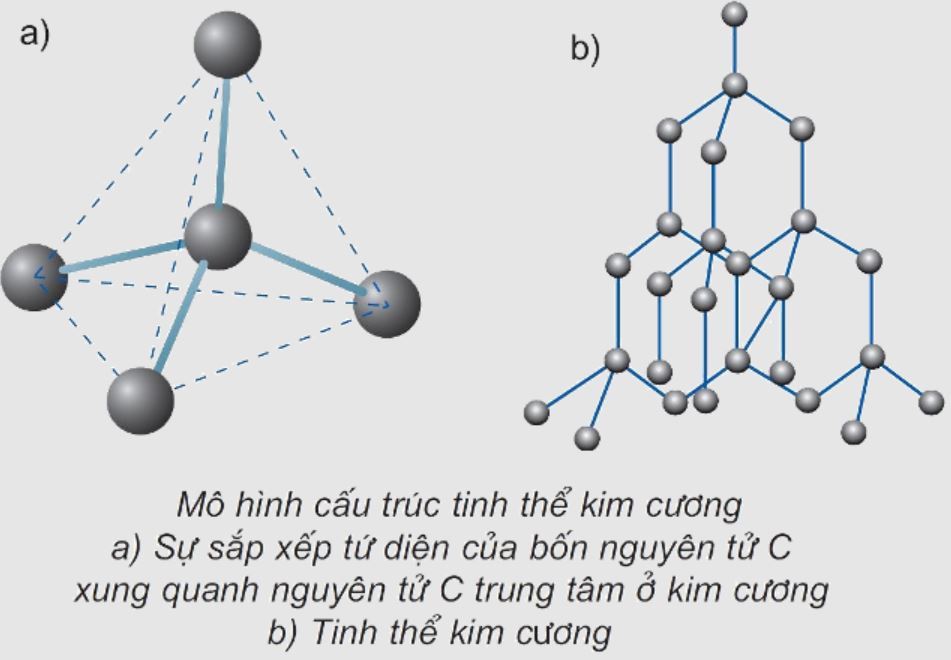
Cấu trúc phân tử kim cương được hình thành từ các nguyên tử carbon thuần khiết. Mỗi nguyên tử carbon có 4 electron hóa trị ở lớp ngoài cùng. Các electron này tham gia vào quá trình lai hóa sp3, tạo thành 4 orbital lai hóa định hướng theo hình tứ diện.
Trong quá trình giảng dạy, tôi thường ví von cấu trúc này như một tòa lâu đài vững chắc. Mỗi nguyên tử carbon giống như một viên gạch được gắn kết với 4 viên gạch khác theo góc 109°28′. Điều này giúp học sinh dễ hình dung hơn về cấu trúc phức tạp này.
Liên kết cộng hóa trị trong tinh thể kim cương
Liên kết trong kim cương là liên kết cộng hóa trị mạnh. Mỗi nguyên tử carbon chia sẻ 4 electron với 4 nguyên tử carbon lân cận. Năng lượng liên kết cao làm cho kim cương trở thành chất rắn có độ cứng cao nhất trong tự nhiên.
Tương tự như công thức của thép, liên kết trong kim cương quyết định tính chất vật lý của nó. Tuy nhiên, kim cương có cấu trúc đơn giản hơn vì chỉ chứa một loại nguyên tử.
Mạng tinh thể kim cương hình lập phương
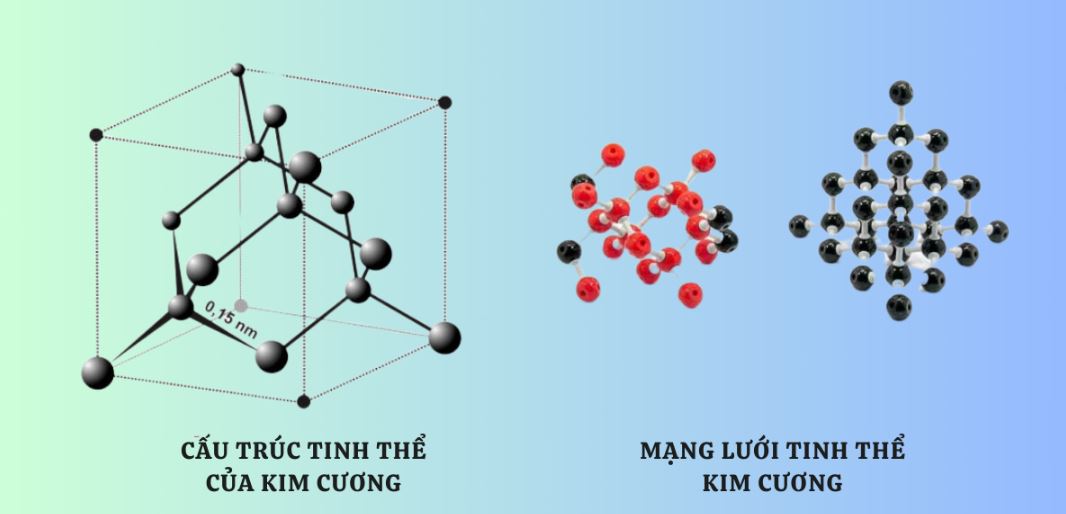
Cấu tạo nguyên tử kim cương tạo thành mạng tinh thể lập phương tâm mặt. Mỗi ô cơ sở chứa 8 nguyên tử carbon ở các đỉnh và 6 nguyên tử ở tâm các mặt. Khoảng cách giữa các nguyên tử carbon là 1.54Å.
Cấu trúc này tạo nên độ đối xứng cao, giúp kim cương có khả năng khúc xạ ánh sáng tuyệt vời. Đây là lý do kim cương được sử dụng làm đá quý và có giá trị cao trong trang sức.
Đặc điểm cấu tạo và tính chất của kim cương
Kim cương là dạng đặc biệt của cacbon tinh thể với đặc điểm cấu tạo kim cương độc đáo. Mỗi nguyên tử cacbon trong kim cương liên kết cộng hóa trị với 4 nguyên tử cacbon khác theo cấu trúc tứ diện. Cấu trúc này tạo nên một mạng tinh thể 3 chiều vô cùng bền vững, giống như than đá công thức hóa học nhưng có độ tinh khiết cao hơn nhiều.
Cấu trúc không gian đặc biệt
Cấu trúc không gian kim cương được hình thành từ các liên kết sp3 của cacbon. Mỗi nguyên tử cacbon nằm ở tâm của một tứ diện đều và liên kết với 4 nguyên tử cacbon ở 4 đỉnh. Góc liên kết giữa các nguyên tử là 109°28′, tạo nên cấu trúc vô cùng đối xứng.
Các nguyên tử cacbon sắp xếp theo mạng lập phương tâm mặt. Khoảng cách giữa các nguyên tử cacbon là 0,154 nm, tạo nên một cấu trúc rất chặt chẽ và ổn định.
Độ cứng và tính chất vật lý
Kim cương có độ cứng cao nhất trong tất cả các chất tự nhiên, đạt 10 trên thang Mohs. Điều này là do mạng tinh thể 3 chiều với các liên kết cộng hóa trị bền vững.
Mật độ của kim cương là 3,52 g/cm3, thấp hơn nhiều so với các kim loại quý khác. Kim cương tinh khiết hoàn toàn trong suốt và không màu.
Theo nghiên cứu của Viện Công nghệ Massachusetts (MIT), độ cứng của kim cương có thể thay đổi tùy thuộc vào hướng tinh thể, với sự chênh lệch lên đến 30%.
Khả năng dẫn nhiệt và điện
Kim cương tinh khiết là chất cách điện tốt do không có electron tự do. Tuy nhiên, nó lại có khả năng dẫn nhiệt rất cao, gấp 5 lần đồng nguyên chất.
Các dao động mạng tinh thể truyền năng lượng nhiệt hiệu quả qua cấu trúc kim cương. Ở nhiệt độ phòng, độ dẫn nhiệt của kim cương đạt khoảng 2200 W/(m·K).
Một số ứng dụng quan trọng của tính chất này là làm bộ tản nhiệt trong các thiết bị điện tử công suất cao và làm dụng cụ cắt gọt chính xác.
So sánh cấu tạo kim cương với các dạng thù hình của cacbon
Cacbon có nhiều dạng thù hình khác nhau, trong đó cấu tạo kim cương là dạng đặc biệt nhất. Kim cương và than chì là hai dạng thù hình phổ biến nhất của cacbon.
Mỗi nguyên tử cacbon trong kim cương liên kết với 4 nguyên tử cacbon khác theo dạng tứ diện. Các liên kết này tạo thành mạng tinh thể không gian ba chiều rất bền vững.
Trong khi đó, than chì có cấu trúc lớp với các nguyên tử cacbon liên kết với nhau theo dạng lục giác phẳng. Các lớp này xếp chồng lên nhau và liên kết yếu.
Cấu trúc tinh thể kim cương và than chì
Tinh thể kim cương có cấu trúc lập phương tâm mặt. Mỗi nguyên tử cacbon nằm ở tâm của một tứ diện đều và liên kết cộng hóa trị với 4 nguyên tử cacbon ở 4 đỉnh.
Các liên kết trong kim cương có độ dài 0.154 nm và góc liên kết 109°28′. Cấu trúc này tạo nên độ cứng cực đại cho kim cương.
Than chì có cấu trúc lớp với khoảng cách giữa các lớp là 0.335 nm. Các lớp này có thể trượt lên nhau dễ dàng do lực liên kết yếu, tạo nên tính mềm của than chì.
Sự khác biệt về tính chất
Kim cương là chất rắn trong suốt, có độ cứng cao nhất trong tự nhiên. Nó không dẫn điện do không có electron tự do và có điểm nóng chảy rất cao (khoảng 3500°C).

Than chì có màu đen xám, mềm và dễ bị bong tróc thành từng lớp. Nó có khả năng dẫn điện do có electron tự do giữa các lớp. công thức hóa học của bạc cũng có cấu trúc tinh thể tương tự.
Sự khác biệt về tính chất này hoàn toàn do cấu trúc tinh thể quyết định, mặc dù cả hai đều được cấu tạo từ nguyên tử cacbon.
FAQ: Câu hỏi thường gặp về kim cương
Kim cương là một trong những vật liệu quý giá và độc đáo nhất trong tự nhiên. Với công thức hóa học của kim cương là C (cacbon tinh khiết), nó có nhiều đặc tính đáng kinh ngạc.
Kim cương có thể chuyển hóa thành than chì không?
Kim cương và than chì đều có thành phần là cacbon nguyên chất. Tuy nhiên, chúng có cấu trúc mạng tinh thể kim cương khác nhau hoàn toàn.
Trong điều kiện nhiệt độ cao (khoảng 1500-2000°C) và áp suất thường, kim cương có thể chuyển hóa thành than chì. Quá trình này tương tự như công thức hóa học đồng sunfat khi bị phân hủy ở nhiệt độ cao.
Tại sao kim cương lại cứng nhất trong tự nhiên?
Độ cứng của kim cương đạt 10 trên thang Mohs nhờ cấu trúc tinh thể đặc biệt. Mỗi nguyên tử cacbon liên kết cộng hóa trị với 4 nguyên tử cacbon khác theo hình tứ diện.
Các liên kết này cực kỳ bền vững và đồng đều theo mọi hướng. Chính vì thế, cần một lực rất lớn mới có thể phá vỡ được cấu trúc này.
Kim cương có thể tổng hợp nhân tạo không?
Kim cương nhân tạo đã được sản xuất thành công từ những năm 1950. Phương pháp phổ biến là mô phỏng điều kiện áp suất và nhiệt độ cao như trong tự nhiên.
Ngày nay, công nghệ CVD (Chemical Vapor Deposition) cho phép tạo ra kim cương chất lượng cao. Kim cương nhân tạo có cùng tính chất vật lý và hóa học với kim cương tự nhiên.
Kiến thức về công thức hóa học của kim cương giúp chúng ta hiểu rõ cấu trúc độc đáo của loại khoáng vật quý này. Kim cương có cấu trúc tinh thể đặc biệt với liên kết cộng hóa trị bền vững giữa các nguyên tử cacbon và mạng tinh thể lập phương tạo nên độ cứng vượt trội. Các đặc tính vật lý và hóa học của kim cương đều xuất phát từ cấu trúc phân tử đặc biệt này. Đây là kiến thức nền tảng quan trọng để nghiên cứu sâu hơn về các dạng thù hình của cacbon trong tự nhiên.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

