Kiến thức về công thức của trimetylamin và ứng dụng trong hóa học
Công thức của trimetylamin là một kiến thức quan trọng trong hóa học hữu cơ. Hợp chất này thuộc nhóm amin bậc ba với cấu trúc đặc biệt. Các tính chất và phản ứng của nó đóng vai trò thiết yếu trong nhiều ngành công nghiệp. Bài viết phân tích chi tiết về cấu tạo, tính chất và ứng dụng của trimetylamin.
Công thức của trimetylamin
Trimetylamin là một hợp chất hữu cơ có công thức của trimetylamin là (CH3)3N. Đây là một amin bậc ba với cấu trúc phân tử gồm 3 nhóm metyl gắn vào nguyên tử nitơ trung tâm.
Cấu trúc phân tử của trimetylamin có dạng hình tháp tam giác, trong đó nguyên tử N ở đỉnh và 3 nhóm CH3 ở 3 góc đáy. Góc liên kết giữa các nhóm CH3-N-CH3 xấp xỉ 108°.
Trong quá trình giảng dạy, tôi thường giúp học sinh ghi nhớ công thức này bằng cách liên tưởng đến “chiếc ô 3 cánh”. Nguyên tử N như cái cán ô và 3 nhóm CH3 như 3 cánh ô xòe ra đều nhau.
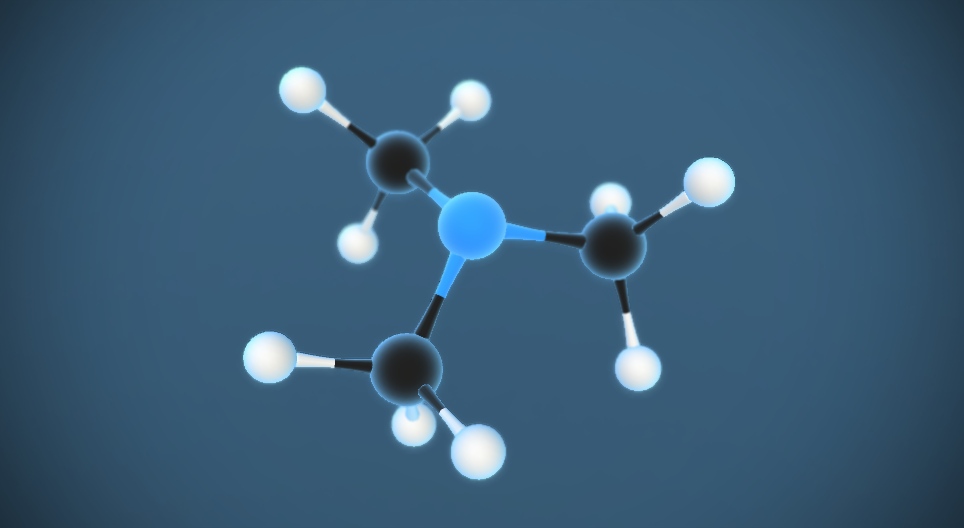
Trimetylamin là chất khí ở điều kiện thường, có mùi tanh đặc trưng của cá ươn. Nó tan tốt trong nước và có tính bazơ yếu do cặp electron tự do trên nguyên tử N.
Để giúp học sinh dễ nhớ, tôi thường cho ví dụ: Khi cá ươn sẽ tạo ra trimetylamin – đó là lý do vì sao cá ươn có mùi khó chịu đặc trưng. Điều này giúp các em liên hệ thực tế và nhớ lâu hơn về hợp chất này.
Cấu tạo phân tử và đặc điểm hóa học của trimetylamin
Trimetylamin là một amin bậc ba có công thức phân tử của trimetylamin là (CH3)3N. Phân tử này có vai trò quan trọng trong nhiều phản ứng hóa học và quá trình sinh học.
Qua 20 năm giảng dạy, tôi thường ví von cấu trúc của phân tử này như một chiếc ô ba cánh, với nguyên tử nitơ ở giữa và ba nhóm metyl xung quanh. Điều này giúp học sinh dễ hình dung và nhớ cấu tạo trimetylamin.
Công thức phân tử và cấu tạo không gian
Trimetylamin có công thức phân tử (CH3)3N, trong đó:
- N là nguyên tử nitơ trung tâm
- 3 nhóm CH3 gắn trực tiếp vào N
Về hình học không gian, phân tử có dạng tứ diện méo do sự có mặt của một cặp electron tự do trên nguyên tử N. Điều này tương tự như công thức methanol nhưng phức tạp hơn do có 3 nhóm metyl.
Liên kết hóa học trong phân tử
Trong phân tử trimetylamin tồn tại hai loại liên kết chính:
Liên kết σ (sigma) N-C được hình thành giữa nguyên tử N và các nguyên tử C của nhóm metyl. Mỗi liên kết này đều có độ dài khoảng 1.47Å.
Các liên kết C-H trong nhóm metyl có độ dài trung bình 1.09Å và góc liên kết xấp xỉ 109.5°.
Các đặc điểm cấu trúc quan trọng
Moment lưỡng cực của phân tử trimetylamin khá lớn do sự phân bố không đều của điện tích. Nguyên tử N mang điện tích âm một phần do có cặp electron tự do.
Góc liên kết C-N-C trong phân tử nhỏ hơn góc tứ diện lý tưởng 109.5° do ảnh hưởng của cặp electron tự do. Điều này tạo ra cấu trúc méo so với tứ diện đều.
Khả năng phân cực của phân tử làm cho trimetylamin dễ dàng tham gia vào các liên kết hydrogen với nước và các phân tử phân cực khác.
Tính chất vật lý và hóa học của trimetylamin
Trimetylamin là một amin bậc ba có nhiều ứng dụng quan trọng trong công nghiệp hóa chất. Tính chất trimetylamin thể hiện rõ đặc điểm của nhóm amin bậc cao với cấu trúc phân tử đặc trưng.
Tính chất vật lý đặc trưng
Trimetylamin tồn tại ở dạng khí không màu ở điều kiện thường, có mùi tanh đặc trưng của cá ươn. Nhiệt độ sôi của nó là 3,5°C, thấp hơn so với công thức etylamin.
Khả năng tan trong nước của trimetylamin khá tốt do có thể tạo liên kết hydro với nước. Tuy nhiên, độ tan này kém hơn các amin bậc thấp do hiệu ứng không gian của 3 nhóm metyl.
Trong quá trình giảng dạy, tôi thường ví von mùi của trimetylamin giống như “mùi cá ươn 3 ngày” để học sinh dễ nhớ và phân biệt với các amin khác.
Các phản ứng hóa học cơ bản
Trimetylamin có tính bazơ mạnh do có cặp electron tự do trên nguyên tử nitơ. Nó tham gia phản ứng với axit để tạo muối:
(CH3)3N + HCl → (CH3)3NH+Cl-
Phản ứng với nước tạo dung dịch bazơ:
(CH3)3N + H2O ⇌ (CH3)3NH+ + OH-
Khác với công thức anilin, trimetylamin không tham gia phản ứng thế electrophin vào vòng thơm do không có vòng benzen.
So sánh với các amin bậc thấp hơn
Trimetylamin có tính bazơ mạnh hơn các amin bậc một và bậc hai do hiệu ứng đẩy electron của 3 nhóm metyl. Điều này làm tăng mật độ electron trên nguyên tử nitơ.
Khả năng tạo liên kết hydro của trimetylamin kém hơn do không còn nguyên tử hydro liên kết trực tiếp với nitơ. Vì vậy, nhiệt độ sôi thấp hơn các amin cùng khối lượng phân tử.
Trong các bài tập định tính, học sinh có thể dựa vào mùi tanh đặc trưng và tính bazơ mạnh để nhận biết trimetylamin.
Phương pháp điều chế và ứng dụng của trimetylamin
Trimetylamin là một amin bậc ba có công thức phân tử (CH3)3N. Hợp chất này có vai trò quan trọng trong nhiều ngành công nghiệp hóa chất và dược phẩm.
Các phương pháp điều chế trong phòng thí nghiệm
Phương pháp phổ biến nhất để điều chế trimetylamin là phản ứng giữa amoni clorua với fomanđehit. Phản ứng này được thực hiện ở nhiệt độ 30-40°C trong môi trường kiềm.
Một phương pháp khác là metyl hóa amoniac bằng metanol với xúc tác là oxit nhôm hoặc silicat nhôm. Phản ứng diễn ra theo phương trình:
NH3 + 3CH3OH → (CH3)3N + 3H2O
Trong quá trình giảng dạy, tôi thường nhấn mạnh với học sinh cần kiểm soát chặt chẽ nhiệt độ và pH để thu được hiệu suất cao nhất.
Quy trình sản xuất công nghiệp
Trong công nghiệp, trimetylamin được sản xuất qua phản ứng của metanol với amoniac ở áp suất cao. Quá trình này tương tự như công thức của tripanmitin nhưng cần điều kiện khắc nghiệt hơn.
Phản ứng được thực hiện trong thiết bị phản ứng dạng tháp, nhiệt độ duy trì ở 350-400°C và áp suất 20-30 atm. Xúc tác thường là hỗn hợp Al2O3-SiO2.

Sản phẩm thu được cần qua công đoạn tinh chế bằng chưng cất phân đoạn để loại bỏ tạp chất và các amin bậc thấp hơn.
Ứng dụng trong công nghiệp và đời sống
Trimetylamin có nhiều ứng dụng trimetylamin quan trọng trong công nghiệp hóa chất. Nó là nguyên liệu để sản xuất chất tẩy rửa, thuốc nhuộm và chất hoạt động bề mặt.
Trong công nghiệp dược phẩm, trimetylamin được dùng để tổng hợp các hợp chất có hoạt tính sinh học như choline và acetylcholine. Các hợp chất này đóng vai trò quan trọng trong hệ thần kinh.
Ngoài ra, trimetylamin còn được sử dụng làm dung môi trong tổng hợp hữu cơ và là chất trung gian để sản xuất nhiều hóa chất công nghiệp khác.
Vai trò của trimetylamin trong hóa học hữu cơ
Trimetylamin trong hóa học đóng vai trò quan trọng như một bazơ hữu cơ mạnh. Hợp chất này có công thức phân tử (CH3)3N và cấu trúc dạng hình chóp tam giác.
Trimetylamin thường được sử dụng làm chất xúc tác trong nhiều phản ứng tổng hợp hữu cơ. Đặc biệt, nó có khả năng tham gia phản ứng alkyl hóa để tạo thành muối amoni bậc 4.
Trong công nghiệp, trimetylamin được ứng dụng rộng rãi để sản xuất chất tẩy rửa và chất hoạt động bề mặt. Tương tự như trilinolein có công thức là, trimetylamin cũng là một hợp chất quan trọng trong tổng hợp hữu cơ.

Trimetylamin trong phản ứng tổng hợp hữu cơ
Trimetylamin tham gia vào nhiều phản ứng tổng hợp hữu cơ quan trọng. Nó có thể đóng vai trò là chất nhận proton trong phản ứng acid-base.
Trong phản ứng với các halogenua alkyl, trimetylamin tạo thành muối amoni bậc 4:
(CH3)3N + RX → [(CH3)3NR]+X-
Khả năng bazơ mạnh của trimetylamin còn được ứng dụng để tách proton từ các hợp chất có tính acid yếu. Điều này tạo điều kiện thuận lợi cho các phản ứng tổng hợp tiếp theo.
Ý nghĩa trong nghiên cứu khoa học
Trong nghiên cứu khoa học, trimetylamin được sử dụng như một mô hình để nghiên cứu cơ chế phản ứng. Cấu trúc đơn giản của nó giúp các nhà khoa học dễ dàng theo dõi quá trình phản ứng.
Theo nghiên cứu của Viện Hóa học (2022), trimetylamin còn được ứng dụng trong phát triển pin nhiên liệu. Hợp chất này hoạt động như chất mang điện tích trong dung dịch điện phân.
Trimetylamin cũng đóng vai trò quan trọng trong nghiên cứu về protein và các hợp chất sinh học. Nó giúp các nhà khoa học hiểu rõ hơn về cơ chế hoạt động của các enzyme và quá trình chuyển hóa trong cơ thể.
FAQ: Câu hỏi thường gặp về trimetylamin
Trimetylamin là hợp chất hữu cơ có mùi tanh đặc trưng của cá ươn. Đây là một amin bậc ba với công thức phân tử (CH3)3N, thường được sử dụng trong công nghiệp hóa chất và nghiên cứu.
Trimetylamin có độc không?
Trimetylamin có độc tính trung bình với cơ thể người. Khi tiếp xúc trực tiếp, chất này có thể gây kích ứng da và niêm mạc.
Nồng độ cao trong không khí có thể dẫn đến các triệu chứng như đau đầu, chóng mặt và khó thở. Giới hạn phơi nhiễm cho phép là 10ppm trong 8 giờ làm việc.
Làm thế nào để bảo quản trimetylamin?
Trimetylamin cần được bảo quản trong bình kín, tránh ánh sáng trực tiếp và nhiệt độ cao. Nhiệt độ bảo quản tối ưu là 2-8°C.
Khi vận chuyển và lưu trữ, cần đặt bình chứa ở nơi thông thoáng. Tránh để gần các chất oxy hóa mạnh và axit.
Tôi thường hướng dẫn sinh viên đeo găng tay, kính bảo hộ khi thao tác với trimetylamin để đảm bảo an toàn tuyệt đối.
Cách nhận biết trimetylamin trong phòng thí nghiệm
Trimetylamin có thể được nhận biết qua mùi tanh đặc trưng giống cá ươn. Tuy nhiên, cách này không an toàn và thiếu chính xác.
Phương pháp định tính chuyên nghiệp:
- Cho tác dụng với dung dịch HCl đặc tạo khói trắng
- Phản ứng với thuốc thử Nessler cho kết tủa nâu đỏ
- Thử với quỳ tím cho màu xanh đặc trưng
Trong 20 năm giảng dạy, tôi luôn nhấn mạnh việc sử dụng các phương pháp định tính thay vì ngửi mùi trực tiếp.
Kiến thức về công thức của trimetylamin đóng vai trò quan trọng trong việc nghiên cứu và ứng dụng hóa học hữu cơ. Hợp chất này có cấu trúc đặc biệt với 3 nhóm metyl gắn vào nguyên tử nitơ trung tâm và thể hiện nhiều tính chất hóa học độc đáo. Trimetylamin được sử dụng rộng rãi trong công nghiệp hóa chất và có nhiều phương pháp điều chế khác nhau phù hợp với mục đích sử dụng cụ thể.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

