Phân tích axit oxalic công thức và tính chất hóa học cơ bản
Axit oxalic công thức là một hợp chất hữu cơ quan trọng trong tự nhiên. Chất này tồn tại phổ biến trong rau củ quả và có nhiều ứng dụng trong công nghiệp. Axit này có tính chất đặc biệt và cần được sử dụng đúng cách để tránh tác hại.
Axit oxalic công thức và cấu tạo
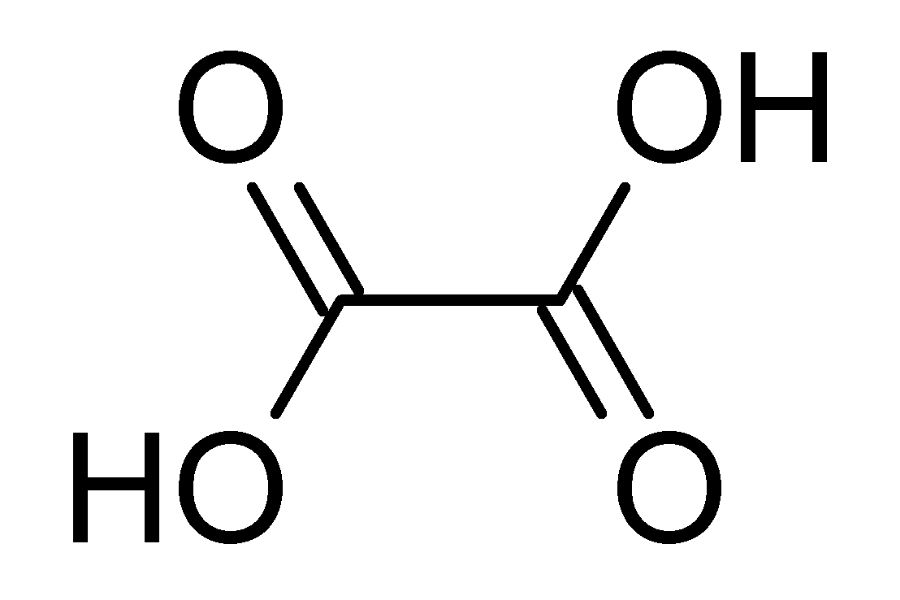
Axit oxalic có công thức phân tử là H2C2O4 và công thức cấu tạo là HOOC-COOH. Đây là một axit dicarboxylic đơn giản nhất trong tự nhiên.
Axit oxalic công thức cấu tạo cho thấy phân tử có 2 nhóm cacboxyl (-COOH) liên kết với nhau. Điều này giúp giải thích tính axit mạnh hơn so với các axit cacboxylic đơn như axit salicylic công thức.
Trong phòng thí nghiệm, tôi thường giải thích cho học sinh về độ mạnh của axit oxalic bằng cách so sánh với axit pecloric có công thức. Sự có mặt của 2 nhóm -COOH làm tăng khả năng phân ly H+.
Axit oxalic công thức cấu tạo có dạng tinh thể không màu, tan tốt trong nước và cồn. Khi đun nóng đến 189°C, axit oxalic sẽ phân hủy thành CO2 và H2O mà không nóng chảy.
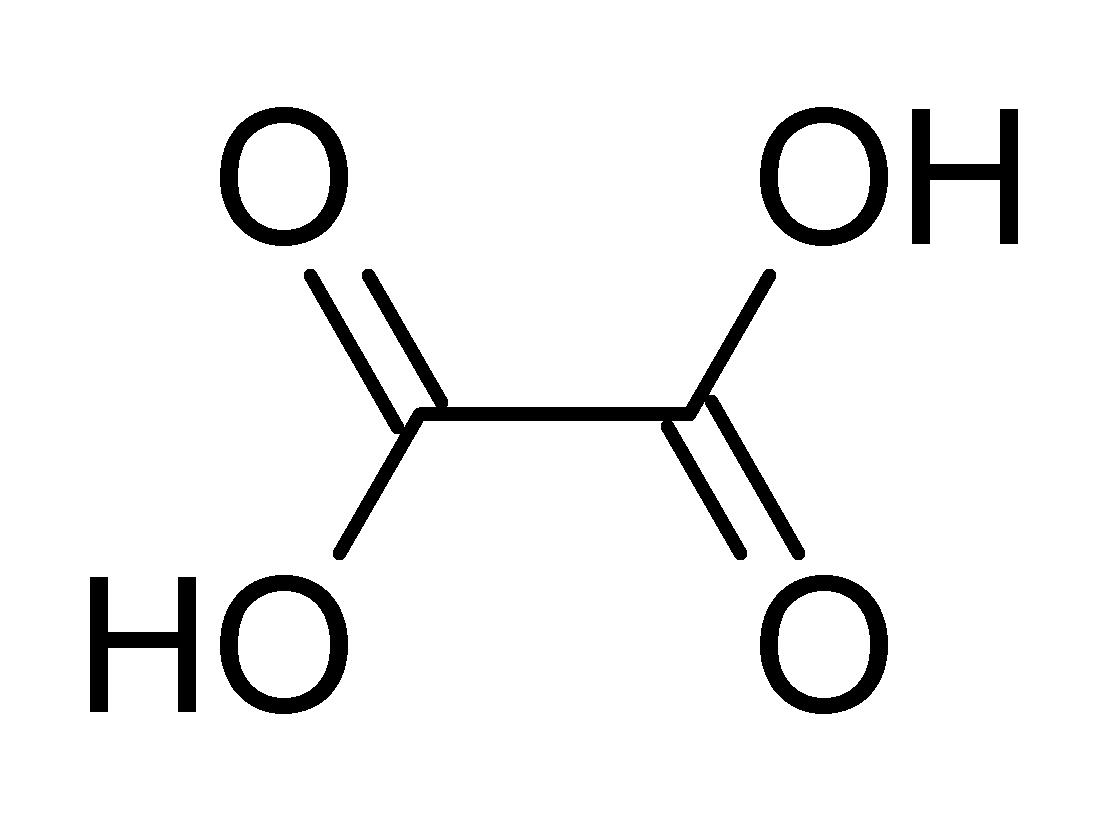
Trong quá trình giảng dạy, tôi thường nhấn mạnh với học sinh về sự khác biệt giữa công thức phân tử và công thức cấu tạo. Công thức cấu tạo giúp hiểu rõ hơn về cách sắp xếp các nguyên tử trong phân tử.
Tính chất hóa học của axit oxalic
Axit oxalic là một axit dicarboxylic có nhiều tính chất hóa học đặc trưng. Axit này có thể tham gia vào nhiều phản ứng khác nhau như phản ứng trao đổi proton, phản ứng với kim loại và phản ứng oxi hóa khử.
Tính axit của axit oxalic
Axit oxalic là một axit có độ mạnh trung bình, mạnh hơn axit lactic công thức. Nó có khả năng phân ly theo hai nấc trong dung dịch nước:
HOOC-COOH ⇌ HOOC-COO- + H+
HOOC-COO- ⇌ -OOC-COO- + H+
Hằng số phân ly Ka1 = 5,9 × 10-2 và Ka2 = 6,4 × 10-5 cho thấy nấc phân ly thứ nhất mạnh hơn nấc thứ hai rất nhiều.
Phản ứng với kim loại và bazơ
Tương tự như axit terephtalic công thức, axit oxalic phản ứng được với kim loại đứng trước hydro trong dãy hoạt động hóa học:
HOOC-COOH + Zn → (COO)2Zn + H2↑
Với bazơ, axit oxalic tạo thành muối oxalat:
HOOC-COOH + 2NaOH → (COO)2Na2 + 2H2O
Phản ứng này thường được sử dụng để điều chế các muối oxalat trong công nghiệp.
Phản ứng oxi hóa khử
Axit oxalic có tính khử mạnh do có nhóm -COOH. Nó bị oxi hóa bởi các chất oxi hóa mạnh như KMnO4:
5HOOC-COOH + 2KMnO4 + 3H2SO4 → 10CO2↑ + 2MnSO4 + K2SO4 + 8H2O
Phản ứng này thường được dùng trong phân tích định lượng để xác định nồng độ KMnO4 hoặc axit oxalic.
Trong môi trường axit và nhiệt độ cao, axit oxalic có thể bị phân hủy:
HOOC-COOH → CO2↑ + CO↑ + H2O
Ứng dụng và vai trò của axit oxalic trong đời sống
Axit oxalic là một hợp chất hóa học có nhiều ứng dụng quan trọng trong đời sống và công nghiệp. Hợp chất này có công thức phân tử H2C2O4 với hai nhóm cacboxyl (-COOH).
Ứng dụng trong công nghiệp
Axit oxalic ứng dụng rộng rãi trong ngành công nghiệp dệt may làm chất tẩy trắng vải sợi. Tôi thường giải thích cho học sinh rằng axit này giống như “xà phòng giặt siêu mạnh” trong công nghiệp.

Trong ngành công nghiệp da giày, axit oxalic được dùng để thuộc da và làm sạch các vết ố. Quá trình này tương tự như cách triglixerit công thức là gì tác động lên bề mặt da.
Ngoài ra, axit oxalic còn được sử dụng để tẩy gỉ sét kim loại và làm sạch đá marble. Tôi hay ví von nó như “bàn chải đánh răng” cho các bề mặt kim loại và đá.
Vai trò trong thực phẩm
Axit oxalic trong thực phẩm có vai trò quan trọng với hương vị của nhiều loại rau củ. Nó tạo vị chua đặc trưng trong rau dền, rau chân vịt và củ cải đường.
Tuy nhiên, hàm lượng axit oxalic cao có thể gây kết tủa canxi oxalat trong cơ thể. Điều này tương tự như cách axeton là gì có thể gây ảnh hưởng đến sức khỏe nếu sử dụng quá mức.
Kinh nghiệm giảng dạy cho thấy việc nấu chín kỹ rau củ sẽ giúp giảm hàm lượng axit oxalic đáng kể.
Sử dụng trong phòng thí nghiệm
Trong phòng thí nghiệm, axit oxalic được sử dụng làm chất chuẩn trong phân tích thể tích. Tôi thường hướng dẫn sinh viên pha dung dịch chuẩn từ tinh thể axit oxalic khan.
Axit oxalic cũng là tác nhân khử mạnh trong nhiều phản ứng hóa học. Nó có thể khử permanganat trong môi trường axit tạo thành muối Mn2+.
Qua 20 năm giảng dạy, tôi nhận thấy việc sử dụng axit oxalic trong thí nghiệm đòi hỏi kỹ năng thao tác cẩn thận và tuân thủ nghiêm ngặt quy tắc an toàn phòng thí nghiệm.
Độc tính và tác hại của axit oxalic
Axit oxalic là một hợp chất hóa học có độc tính và tác hại nghiêm trọng đối với cơ thể con người. Chất này thường xuất hiện tự nhiên trong một số loại rau củ như rau chân vịt và rau dền.

Tương tự như ancol anlylic có công thức là, axit oxalic có khả năng gây độc cấp tính khi tiếp xúc trực tiếp. Nó cũng có thể tích tụ trong cơ thể như cách ancol butylic công thức tác động lên gan.
Nguy cơ ngộ độc axit oxalic
Ngộ độc axit oxalic thường xảy ra qua đường tiêu hóa khi ăn phải thực phẩm chứa hàm lượng cao. Các triệu chứng ban đầu bao gồm buồn nôn, đau bụng và nôn mửa.
Tiếp xúc trực tiếp với da hoặc niêm mạc có thể gây bỏng hóa học nghiêm trọng. Điều này đặc biệt nguy hiểm với trẻ em và người già.
Tác động đến sức khỏe
Axit oxalic khi vào cơ thể sẽ kết hợp với canxi tạo thành oxalat canxi không tan. Quá trình này làm giảm nồng độ canxi trong máu gây ra nhiều biến chứng.
Sỏi thận là một trong những tác hại lâu dài khi tiêu thụ nhiều thực phẩm giàu axit oxalic. Các tinh thể oxalat tích tụ dần trong thận tạo thành sỏi.
Theo nghiên cứu của Đại học Y Hà Nội, 65% ca sỏi thận có liên quan đến việc tiêu thụ thực phẩm giàu axit oxalic.
Cách phòng tránh
Hạn chế ăn các thực phẩm có hàm lượng axit oxalic cao như rau chân vịt, rau dền. Nên luộc kỹ các loại rau này trước khi ăn.
Bổ sung đầy đủ canxi từ sữa và các sản phẩm từ sữa. Canxi sẽ kết hợp với axit oxalic trong đường tiêu hóa, giúp giảm hấp thu vào máu.
Uống nhiều nước để tránh tình trạng kết tinh oxalat trong thận. Người có tiền sử sỏi thận cần đặc biệt lưu ý chế độ ăn uống.
FAQ: Câu hỏi thường gặp về axit oxalic
Axit oxalic là một hợp chất hóa học quan trọng được sử dụng rộng rãi trong công nghiệp và đời sống. Tuy nhiên, nhiều người vẫn còn thắc mắc về tính chất và cách sử dụng an toàn của nó. Cùng tìm hiểu một số câu hỏi phổ biến về axit oxalic.
Axit oxalic có tồn tại tự nhiên không?
Axit oxalic tồn tại phổ biến trong tự nhiên, đặc biệt trong các loại rau củ như rau chân vịt và rau dền. Nó cũng được tìm thấy trong công thức acetaldehyde của một số loại nấm.
Hàm lượng axit này trong thực vật thay đổi theo mùa và điều kiện môi trường. Ví dụ, rau chân vịt chứa khoảng 0.5-1.3% axit oxalic trong lá.
Làm thế nào để bảo quản axit oxalic an toàn?
Axit oxalic cần được bảo quản trong bình kín, tránh ánh nắng trực tiếp và nhiệt độ cao. Tương tự như ether ethylic công thức, nó cần được đặt trong tủ hóa chất riêng biệt.
Nhiệt độ bảo quản tối ưu là 15-25°C. Phòng chứa cần thông thoáng và tránh xa tầm với của trẻ em.
Cách xử lý khi bị axit oxalic bắn vào da?
Khi bị axit oxalic bắn vào da, cần rửa ngay vùng da bị ảnh hưởng dưới vòi nước sạch trong 15-20 phút. Tránh chà xát mạnh vùng da bị bắn axit.
Sau khi rửa sạch, thấm khô nhẹ nhàng và bôi kem chống kích ứng. Nếu vết bỏng nặng, cần đến cơ sở y tế để được điều trị kịp thời.
Kiến thức về axit oxalic công thức đóng vai trò quan trọng trong việc học tập và nghiên cứu hóa học. Đây là một hợp chất hữu cơ phổ biến trong tự nhiên với những tính chất đặc trưng và ứng dụng đa dạng. Tuy nhiên, cần lưu ý về độc tính của axit oxalic để sử dụng an toàn và hiệu quả trong đời sống, công nghiệp và phòng thí nghiệm. Việc nắm vững cấu tạo, tính chất và cách phòng tránh tác hại giúp phát huy tối đa giá trị của hợp chất này.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

