Nắm rõ công thức metanol và tính chất hóa học quan trọng
Công thức metanol là kiến thức nền tảng trong hóa học hữu cơ. Chất này có cấu trúc phân tử đơn giản nhưng ứng dụng rộng rãi trong công nghiệp. Metanol cũng là chất độc nguy hiểm cần được sử dụng đúng cách và có biện pháp phòng ngừa phù hợp.
Công thức metanol
Metanol là một hợp chất hữu cơ đơn giản nhất trong dãy ancol. Công thức metanol là CH3OH, còn được gọi là rượu methyl.
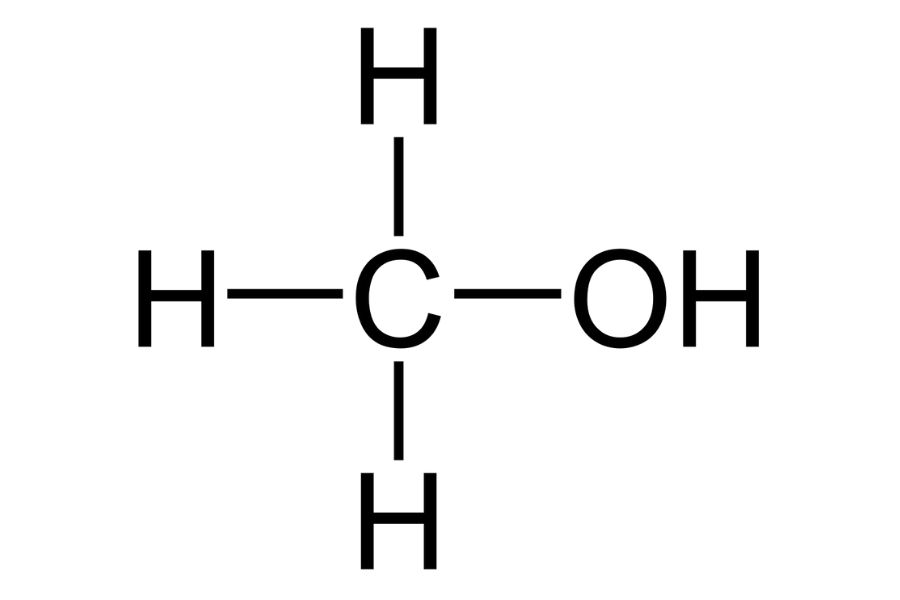
Cấu tạo phân tử metanol gồm một nhóm hydroxyl (-OH) liên kết với một nhóm methyl (-CH3). Công thức của metanol có thể được viết dưới dạng cấu tạo đầy đủ là H-CH2-OH.
Trong quá trình giảng dạy, tôi thường giúp học sinh ghi nhớ công thức này bằng cách chia thành 2 phần:
- C<h3>nhóm methyl, chứa 1 nguyên tử carbon và 3 nguyên tử hydro</h3>- OH: nhóm hydroxyl, đặc trưng của ancol
Metanol có khối lượng phân tử là 32 đvC, được tính như sau:
C: 1 x 12 = 12
H: 4 x 1 = 4
O: 1 x 16 = 16
Tổng = 32 đvC
Một mẹo nhỏ để phân biệt metanol với ethanol: Metanol chỉ có 1 carbon (CH3OH) còn ethanol có 2 carbon (C2H5OH). Metanol rất độc, có thể gây mù mắt và tử vong nếu uống phải.
Cấu tạo và đặc điểm phân tử của metanol CH3OH
Phân tử metanol có cấu tạo metanol khá đơn giản với một nhóm methyl (-CH3) liên kết với nhóm hydroxyl (-OH). Đây là rượu đơn giản nhất trong dãy đồng đẳng của rượu no, đơn chức, mạch hở. công thức của methanol cho thấy phân tử này có khối lượng phân tử là 32 đvC.
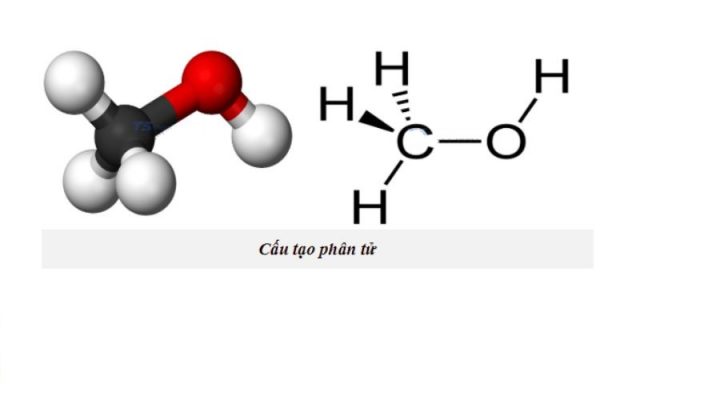
Cấu trúc của metanol CH3OH đóng vai trò quan trọng trong các phản ứng hóa học và ứng dụng công nghiệp. Phân tử này có thể tham gia phản ứng thế, cộng và oxi hóa. công thức hóa học của metan có cấu trúc tương tự nhưng thay nhóm -OH bằng -H.
Cấu trúc phân tử metanol
Phân tử metanol có cấu trúc ba chiều dạng tứ diện méo. Nguyên tử carbon ở trung tâm liên kết với 3 nguyên tử hydro và 1 nhóm -OH.
Góc liên kết H-C-H xấp xỉ 109,5° giống như trong metan. Tuy nhiên, góc H-C-O hơi nhỏ hơn do ảnh hưởng của cặp electron tự do trên nguyên tử oxi.
Liên kết trong phân tử metanol
Liên kết C-H trong phân tử là liên kết cộng hóa trị không phân cực. Độ dài liên kết C-H khoảng 0,109 nm.
Liên kết C-O có tính phân cực do độ âm điện của oxi lớn hơn carbon. Độ dài liên kết C-O khoảng 0,143 nm.
Liên kết O-H cũng có tính phân cực mạnh, tạo điều kiện cho phân tử tham gia liên kết hydro với các phân tử khác.
Các đặc điểm hình học của phân tử
Phân tử metanol có dạng hình học tứ diện méo với nguyên tử carbon sp3 ở trung tâm. Các góc liên kết không hoàn toàn bằng nhau.
Sự có mặt của nhóm -OH làm cho phân tử phân cực. Moment lưỡng cực của metanol là 1,7 D, lớn hơn so với nước (1,85 D).
Cấu trúc không gian này cho phép phân tử tạo liên kết hydro với các phân tử khác, giải thích nhiệt độ sôi cao bất thường của metanol.
Tính chất vật lý và hóa học của metanol
Metanol là một chất lỏng không màu với mùi đặc trưng nhẹ. Tính chất metanol bao gồm nhiều đặc điểm quan trọng cần nắm vững để sử dụng an toàn và hiệu quả.

Các tính chất vật lý cơ bản
Metanol có nhiệt độ sôi thấp ở 64,7°C và nhiệt độ đông đặc -97,6°C. Công thức metanol CH3OH cho thấy đây là rượu đơn giản nhất trong dãy đồng đẳng.
Khối lượng riêng của metanol ở 20°C là 0,792 g/ml. Chất này tan vô hạn trong nước nhờ liên kết hydro giữa nhóm -OH với phân tử H2O.
Metanol dễ bay hơi ở điều kiện thường do lực liên kết phân tử yếu. Đây là điểm cần lưu ý khi bảo quản và sử dụng.
Phản ứng hóa học đặc trưng
Metanol tham gia nhiều phản ứng hóa học quan trọng. Các phản ứng chính bao gồm oxi hóa, phản ứng với kim loại kiềm và este hóa.
Phản ứng oxi hóa
Metanol bị oxi hóa thành formaldehyd (HCHO) khi có xúc tác Cu ở 300°C. Phản ứng này tạo ra metyl fomat có công thức cấu tạo là khi tiếp tục oxi hóa.
Trong phòng thí nghiệm, tôi thường dùng K2Cr2O7/H2SO4 để oxi hóa metanol thành formaldehyd. Màu cam của dung dịch K2Cr2O7 chuyển sang xanh lục rất đẹp mắt.
Phản ứng với kim loại kiềm
Metanol phản ứng với Na tạo natri metylat (CH3ONa) và giải phóng khí H2. Phản ứng xảy ra mạnh mẽ kèm tỏa nhiệt.
Khi thực hiện phản ứng này, tôi luôn nhắc học sinh phải cẩn thận vì Na rất hoạt động. Cần thực hiện trong tủ hút với lượng nhỏ.
Phản ứng este hóa
Metanol tham gia phản ứng este hóa với axit cacboxylic tạo este. Ví dụ với axit metacrylic tạo công thức cấu tạo của metyl metacrylat.
Phản ứng este hóa thường cần xúc tác axit và đun nóng. Sản phẩm tạo thành có mùi thơm đặc trưng của trái cây.
Trong giảng dạy, tôi thường cho học sinh thực hành este hóa metanol với axit axetic để tạo metyl axetat có mùi chuối chín.
Độc tính và tác hại của metanol đối với cơ thể
Metanol là gì? Đây là một chất lỏng không màu, dễ bay hơi và có mùi đặc trưng giống rượu etylic. Metanol thường được sử dụng làm dung môi công nghiệp và nhiên liệu.
Metanol có độc tính cao với cơ thể người, chỉ cần uống 10ml có thể gây mù mắt và 30ml có thể gây tử vong. Tương tự như cấu tạo paracetamol, metanol cũng có nhóm hydroxyl (-OH) nhưng độc tính cao hơn nhiều lần.
Metanol độc như thế nào khi xâm nhập vào cơ thể? Chất này sẽ chuyển hóa thành formaldehyd và axit formic – hai chất cực độc với não, thần kinh thị giác và các cơ quan nội tạng.

Cơ chế gây độc của metanol
Khi vào cơ thể, metanol được chuyển hóa qua 2 giai đoạn chính bởi enzyme alcohol dehydrogenase (ADH). Đầu tiên, ADH chuyển metanol thành formaldehyd.
Formaldehyd tiếp tục bị oxy hóa thành axit formic bởi enzyme aldehyd dehydrogenase. Axit formic tích tụ gây toan hóa máu nghiêm trọng.
Quá trình này làm tổn thương não, thần kinh thị giác và các cơ quan nội tạng. Đặc biệt, tổn thương thần kinh thị giác có thể không hồi phục.
Triệu chứng ngộ độc metanol
Các triệu chứng ban đầu thường xuất hiện sau 12-24 giờ tiếp xúc, bao gồm đau đầu, chóng mặt và buồn nôn. Người bệnh có thể bị rối loạn thị giác, nhìn mờ hoặc mù.
Tiếp theo là các dấu hiệu tổn thương não như co giật, hôn mê. Nạn nhân có thể bị khó thở, tim đập nhanh và tụt huyết áp.
Theo thống kê của Cục An toàn thực phẩm, mỗi năm Việt Nam ghi nhận hàng trăm ca ngộ độc metanol, với tỷ lệ tử vong cao nếu không được điều trị kịp thời.
Cách xử lý khi bị ngộ độc
Ngay khi phát hiện ngộ độc metanol, cần đưa nạn nhân đến cơ sở y tế gần nhất càng sớm càng tốt. Không tự ý điều trị tại nhà vì rất nguy hiểm.
Bác sĩ sẽ tiến hành rửa dạ dày, lọc máu để loại bỏ metanol. Đồng thời cho uống ethanol hoặc fomepizol để ức chế enzyme ADH, ngăn chặn chuyển hóa metanol thành chất độc.
Việc điều trị cần được thực hiện càng sớm càng tốt để hạn chế tổn thương não và thần kinh thị giác. Quá trình điều trị có thể kéo dài nhiều ngày tùy mức độ ngộ độc.
FAQ: Câu hỏi thường gặp về metanol
Metanol là một chất quan trọng trong công nghiệp hóa chất. Công thức của metanol là CH3OH, còn được gọi là methyl alcohol. Dưới đây là một số câu hỏi phổ biến về hợp chất này.
Metanol và ethanol khác nhau như thế nào?
Metanol và ethanol có cấu trúc phân tử khác biệt rõ rệt. Metanol chỉ có 1 nhóm -CH3, trong khi ethanol có 2 nhóm -CH2CH3.
Metanol độc hơn ethanol rất nhiều. Chỉ cần uống 10ml metanol có thể gây mù lòa, 30ml có thể gây tử vong. Ethanol như trong công thức butan ít độc hơn.
Về mặt ứng dụng, metanol chủ yếu dùng trong công nghiệp, còn ethanol được sử dụng trong đồ uống có cồn.
Làm thế nào để nhận biết metanol?
Metanol có mùi đặc trưng giống rượu ethanol nhưng nhẹ hơn. Phương pháp an toàn nhất là dùng các thuốc thử hóa học.
Thử với dung dịch KMnO4, metanol sẽ làm mất màu tím của thuốc thử. Cách này tương tự như công thức vôi tôi khi phản ứng.
Có thể dùng phương pháp đo điểm sôi, metanol sôi ở 64.7°C trong khi ethanol sôi ở 78.37°C.
Metanol có những ứng dụng gì trong công nghiệp?
Metanol được sử dụng làm dung môi trong nhiều ngành công nghiệp. Nó hòa tan được nhiều chất hữu cơ.
Trong công nghiệp hóa dầu, metanol là nguyên liệu sản xuất formaldehyde và nhiều hợp chất quan trọng khác.
Metanol còn được dùng làm nhiên liệu trong động cơ đốt trong, đặc biệt là xe đua công thức 1.
Kiến thức về công thức metanol là nền tảng quan trọng trong chương trình hóa học phổ thông và đại học. Phân tử CH3OH có cấu trúc đơn giản nhưng đóng vai trò thiết yếu trong công nghiệp hóa chất. Tuy nhiên, metanol là chất độc nguy hiểm cần được sử dụng đúng cách và có biện pháp bảo vệ phù hợp. Việc nắm vững cấu tạo và tính chất của metanol giúp học sinh vận dụng tốt trong học tập và thực tiễn.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

