Tìm hiểu nước vôi trong công thức và ứng dụng trong thí nghiệm hóa học
Nước vôi trong công thức là dung dịch trong suốt được sử dụng phổ biến trong phòng thí nghiệm. Dung dịch này có nhiều tính chất hóa học đặc biệt và ứng dụng quan trọng. Bài viết phân tích chi tiết cách pha chế, tính chất và các phản ứng đặc trưng của dung dịch này.
Nước vôi trong là gì?
Nước vôi trong là gì? Đó là dung dịch trong suốt của canxi hydroxit Ca(OH)2 trong nước. Dung dịch này được tạo thành khi hòa tan vôi sống CaO vào nước.

Phản ứng tạo nước vôi trong diễn ra qua 2 giai đoạn:
CaO + H2O → Ca(OH)2
(Vôi sống + Nước → Vôi tôi)
Ca(OH)2 + H2O → Ca(OH)2 (dung dịch)
(Vôi tôi + Nước → Nước vôi trong)
Trong quá trình giảng dạy, tôi thường ví von nước vôi trong công thức như một ly nước chanh đường – khi hòa tan đường vào nước chanh ta được dung dịch trong suốt. Tương tự, khi hòa tan vôi tôi vào nước, ta được dung dịch trong suốt của Ca(OH)2.
Một điều thú vị là nước vôi trong có tính bazơ mạnh với pH khoảng 12,4. Đây là lý do nó được sử dụng rộng rãi trong xây dựng và nông nghiệp để trung hòa đất chua.
Khi để ngoài không khí, nước vôi trong sẽ dần chuyển thành dung dịch đục do phản ứng với CO2:
Ca(OH)2 + CO2 → CaCO3↓ + H2O
(Nước vôi trong + Khí cacbonic → Đá vôi + Nước)
Công thức và cách pha nước vôi trong
Nước vôi trong là dung dịch Ca(OH)2 được tạo thành từ phản ứng của vôi sống CaO với nước. Đây là hóa chất phổ biến trong phòng thí nghiệm và đời sống.
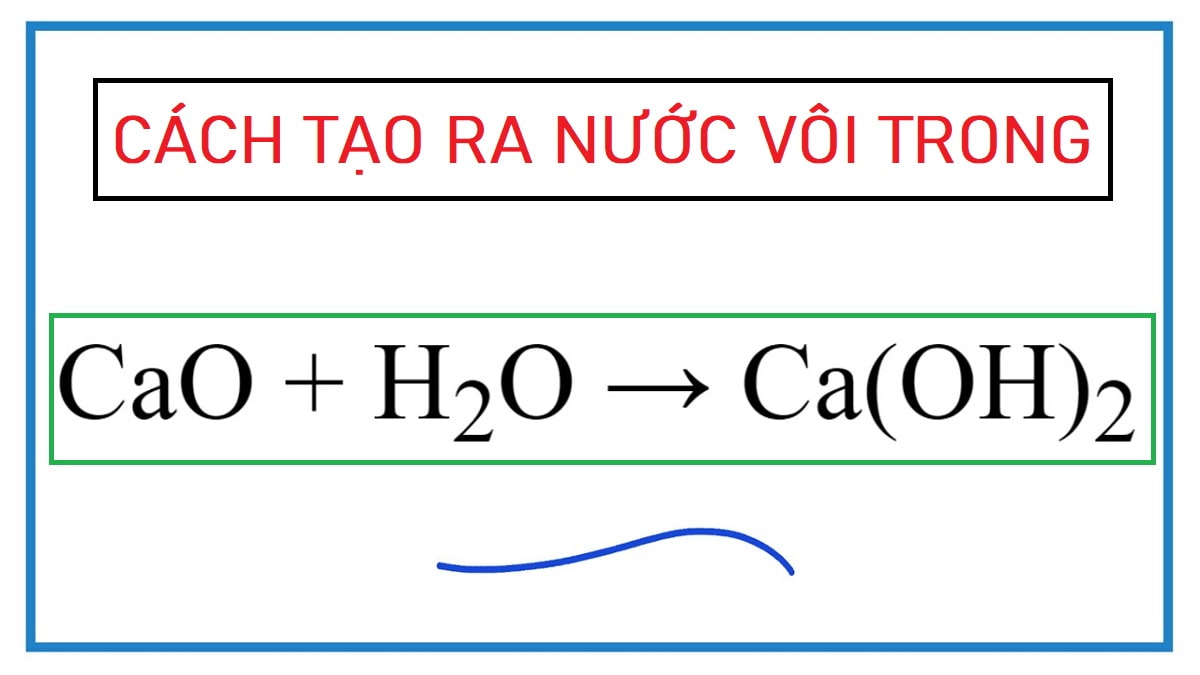
Công thức hóa học của nước vôi trong
Công thức nước vôi trong được biểu diễn là Ca(OH)2, thuộc nhóm bazơ có tính kiềm mạnh. Phản ứng tạo thành nước vôi trong diễn ra theo phương trình:
CaO + H2O → Ca(OH)2 + Q
Trong đó:
– CaO là vôi sống, có thể thu được từ thạch cao sống có công thức là
– H2O là nước
– Q là nhiệt lượng tỏa ra trong phản ứng
Quy trình pha chế nước vôi trong chuẩn
Cách pha nước vôi trong cần tuân thủ các bước sau để đảm bảo chất lượng:
- Cho vôi sống vào cốc thủy tinh chịu nhiệt
- Thêm từ từ nước cất vào, khuấy đều
- Đợi hỗn hợp lắng trong khoảng 24 giờ
- Gạn lấy phần dung dịch trong phía trên
Nồng độ Ca(OH)2 bão hòa ở 25°C là 0,02 mol/L. Tôi thường hướng dẫn học sinh pha loãng thêm để có nồng độ phù hợp với thí nghiệm.
Những lưu ý khi pha chế
Qua nhiều năm giảng dạy, tôi nhận thấy một số điểm quan trọng cần chú ý:
Nên sử dụng nước cất hoặc nước đã đun sôi để nguội. Nước máy có thể chứa tạp chất ảnh hưởng đến chất lượng dung dịch.
Không nên dùng dụng cụ kim loại để khuấy vì có thể bị ăn mòn. Tốt nhất là dùng đũa thủy tinh hoặc nhựa chuyên dụng.
Bảo quản trong chai thủy tinh kín, tránh tiếp xúc với không khí để hạn chế phản ứng với CO2 tạo cặn CaCO3.
Tính chất và phản ứng của nước vôi trong
Nước vôi trong là dung dịch Ca(OH)2 bão hòa trong nước. Đây là một hóa chất phổ biến trong phòng thí nghiệm và đời sống. Nước vôi trong tính chất nổi bật là tính bazơ mạnh và khả năng phản ứng đặc trưng với nhiều chất.
Tính chất vật lý
Nước vôi trong có màu trắng đục khi để lâu trong không khí. Ở điều kiện thường, nước vôi trong là dung dịch trong suốt không màu. Độ tan của Ca(OH)2 trong nước khá thấp, chỉ khoảng 0,165g/100g nước ở 20°C.
Trong quá trình giảng dạy, tôi thường nhắc học sinh rằng nước vôi trong giống như “ly nước tinh khiết” – trong suốt và không màu. Điều này giúp các em dễ nhớ và phân biệt với dạng vôi tôi vừa pha.

Tính chất hóa học
Nước vôi trong phản ứng mạnh mẽ với nhiều chất khác nhau. Dung dịch này có tính bazơ mạnh với pH > 12. Ca(OH)2 trong nước phân ly thành các ion theo phương trình:
Ca(OH)2 ⇌ Ca2+ + 2OH-
Phản ứng này có thể đảo ngược, tạo thành cân bằng động trong dung dịch. Khi nhiệt độ tăng, độ tan của Ca(OH)2 giảm, làm dịch chuyển cân bằng về phía tạo kết tủa.
Các phản ứng đặc trưng
Nước vôi trong tham gia nhiều phản ứng quan trọng. Trong đó, công thức đá vôi là một trong những sản phẩm phổ biến từ các phản ứng này.
Phản ứng với CO2
Nước vôi trong tác dụng với CO2 tạo thành kết tủa trắng CaCO3:
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Nếu tiếp tục sục CO2, kết tủa tan dần tạo Ca(HCO3)2:
CaCO3 + CO2 + H2O → Ca(HCO3)2
Phản ứng với axit
Nước vôi trong phản ứng với axit theo phương trình trung hòa điển hình:
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Phản ứng này tạo muối và nước, thường được ứng dụng để trung hòa axit trong xử lý nước thải công nghiệp.
Thí nghiệm và ứng dụng của nước vôi trong
Nước vôi trong là dung dịch Ca(OH)2 bão hòa trong nước, có tính bazơ mạnh và khả năng phản ứng đa dạng. Tôi thường ví von đây là “chất thử vạn năng” trong phòng thí nghiệm hóa học.
Các thí nghiệm tiêu biểu với nước vôi trong
Nước vôi trong thí nghiệm thường được sử dụng để nhận biết khí CO2 thông qua phản ứng tạo kết tủa trắng CaCO3:
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Một thí nghiệm thú vị khác là phản ứng với dung dịch muối amoni. Khi cho NH4Cl vào nước vôi trong và đun nóng nhẹ, khí NH3 bay ra có mùi khai đặc trưng:
Ca(OH)2 + 2NH4Cl → CaCl2 + 2NH3↑ + 2H2O
Ứng dụng trong phòng thí nghiệm
Nước vôi trong ứng dụng rộng rãi làm thuốc thử trong phân tích định tính. Tôi thường hướng dẫn học sinh dùng nó để kiểm tra sự có mặt của ion CO32- trong các mẫu nước.
Nước vôi trong còn được dùng để điều chế bazơ yếu từ muối của chúng. Ví dụ điều chế NH3 từ muối NH4Cl như phản ứng trên.
Trong phòng thí nghiệm, nó còn là tác nhân hấp thụ CO2 hiệu quả khi nghiên cứu các phản ứng sinh khí.
Ứng dụng trong đời sống và công nghiệp
Nước vôi trong công thức xử lý nước thải công nghiệp giúp trung hòa acid và kết tủa các ion kim loại nặng độc hại:
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
Ca(OH)2 + Cu2+ → Cu(OH)2↓ + Ca2+
Trong xây dựng, nước vôi trong được trộn với cát tạo vữa xây. Khi tiếp xúc với CO2 trong không khí, CaCO3 được tạo thành làm cho vữa đông cứng và bền chắc.

Nông nghiệp sử dụng nước vôi trong để điều chỉnh độ pH đất, khử trùng chuồng trại và xử lý nước ao nuôi thủy sản.
FAQ: Câu hỏi thường gặp về nước vôi trong
Các thắc mắc phổ biến về nước vôi trong công thức hóa học sẽ được giải đáp chi tiết. Tôi đã tổng hợp từ kinh nghiệm giảng dạy thực tế để đưa ra những câu trả lời chính xác nhất.
Nước vôi trong có độc không?
Nước vôi trong không độc nhưng cần sử dụng đúng cách. Đây là dung dịch Ca(OH)2 bão hòa có tính kiềm mạnh.
Khi tiếp xúc trực tiếp với da có thể gây kích ứng, bỏng rát. Nếu vô tình uống phải sẽ gây tổn thương niêm mạc đường tiêu hóa.
Tuy nhiên ở nồng độ loãng, nước vôi trong được dùng an toàn trong nhiều ứng dụng như xử lý nước, làm phụ gia thực phẩm.
Bảo quản nước vôi trong như thế nào?
Nước vôi trong cần được bảo quản trong chai thủy tinh kín, tránh ánh nắng trực tiếp. Nhiệt độ bảo quản thích hợp từ 15-25°C.
Không nên để lâu trong chai nhựa vì có thể phản ứng với vật liệu chai. Thời gian bảo quản tối đa 6 tháng.
Cần đậy kín để tránh phản ứng với CO2 trong không khí tạo thành CaCO3 kết tủa trắng.
Nước vôi trong có thể thay thế bằng chất nào?
Trong phòng thí nghiệm, có thể dùng NaOH hoặc KOH thay thế. Các dung dịch này đều có tính kiềm mạnh tương tự.
Với mục đích xử lý nước, có thể thay bằng PAC (Poly Aluminium Chloride) hoặc phèn chua.
Tuy nhiên mỗi chất thay thế đều có ưu nhược điểm riêng và cần cân nhắc kỹ mục đích sử dụng trước khi thay thế.
Kiến thức về nước vôi trong đóng vai trò quan trọng trong chương trình hóa học phổ thông và đại học. Dung dịch này có công thức Ca(OH)2 với những tính chất đặc trưng và phản ứng hóa học đa dạng. Việc nắm vững cách pha chế, bảo quản và ứng dụng nước vôi trong giúp học sinh thực hiện tốt các thí nghiệm trong phòng thí nghiệm. Đồng thời, những ứng dụng thực tiễn của nó trong công nghiệp và đời sống minh họa rõ nét mối liên hệ giữa lý thuyết và thực hành hóa học.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

