Tìm hiểu công thức đá vôi và các phản ứng hóa học quan trọng trong tự nhiên
Công thức đá vôi là kiến thức nền tảng trong chương trình hóa học phổ thông. Đá vôi tồn tại phổ biến trong tự nhiên dưới dạng khoáng vật canxit. Các phản ứng hóa học đặc trưng của đá vôi có vai trò quan trọng trong công nghiệp và đời sống.
Công thức đá vôi là gì?
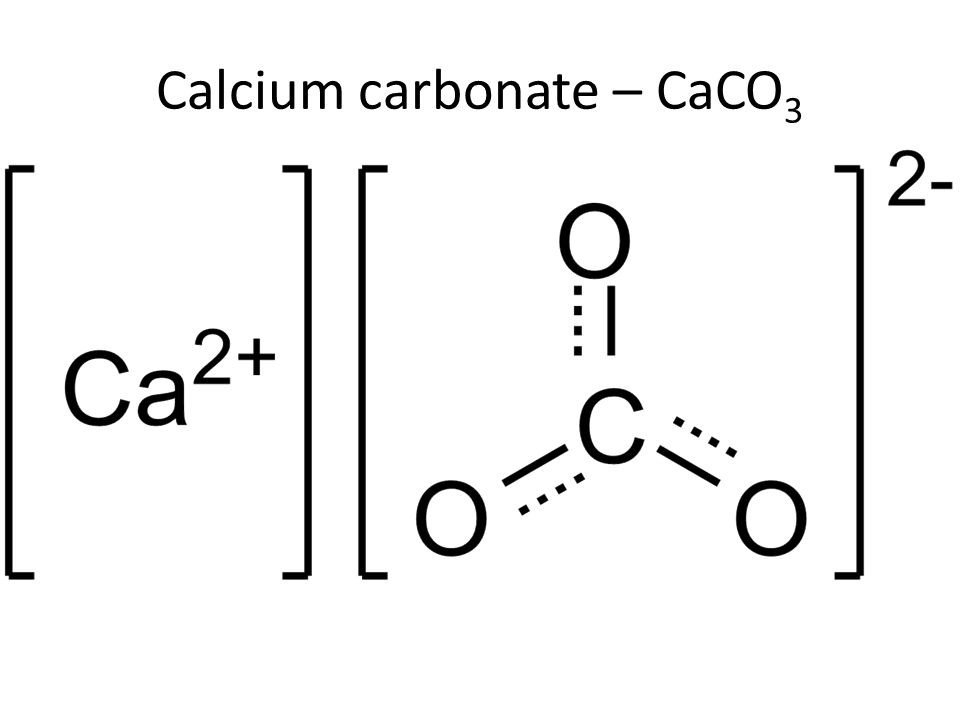
Đá vôi có công thức hóa học là CaCO3 (Canxi cacbonat). Đây là một hợp chất vô cơ phổ biến trong tự nhiên và có nhiều ứng dụng quan trọng.
Công thức đá vôi CaCO3 bao gồm:
– Ca2+: Ion canxi mang điện tích dương
– CO32-: Gốc cacbonat mang điện tích âm
Khi tôi giảng dạy, tôi thường ví von CaCO3 như một “gia đình” gồm “ông bố” Ca2+ và “đứa con” CO32-. Cách này giúp học sinh dễ nhớ thành phần cấu tạo.
Công thức đá vôi là gì khi viết dưới dạng cấu trúc? Đó là một tinh thể có cấu trúc lập phương tâm mặt. Mỗi ion Ca2+ được bao quanh bởi 6 ion CO32- và ngược lại.
Trong phòng thí nghiệm, tôi thường cho học sinh quan sát phản ứng:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Phản ứng này giúp học sinh hiểu rõ tính chất của đá vôi khi tác dụng với axit. Bọt khí CO2 thoát ra sủi bọt rất thú vị.
Thành phần và cấu tạo hóa học của đá vôi trong tự nhiên
Đá vôi trong tự nhiên có thành phần chính là canxi cacbonat (CaCO3). Đây là loại đá trầm tích phổ biến được hình thành qua hàng triệu năm. Cấu tạo của đá vôi khá phức tạp với nhiều dạng tinh thể và tạp chất khác nhau.

Thành phần chính của đá vôi
Canxi cacbonat (CaCO3) chiếm tỷ lệ 90-95% trong thành phần đá vôi. Hợp chất này tồn tại chủ yếu dưới dạng khoáng vật calcite. Calcite có cấu trúc tinh thể hệ lục phương với độ cứng 3 trên thang Mohs.
Trong quá trình giảng dạy, tôi thường ví von calcite như những viên gạch xếp chồng lên nhau tạo nên khối đá vôi. Điều này giúp học sinh dễ hình dung về cấu trúc của nó.
Các tạp chất thường gặp trong đá vôi
Ngoài CaCO3, đá vôi còn chứa các tạp chất như magie cacbonat (MgCO3), sắt oxit (Fe2O3) và silic dioxit (SiO2). Các tạp chất này ảnh hưởng trực tiếp đến màu sắc và độ tinh khiết của đá vôi.
Tương tự như công thức của thạch cao sống, các tạp chất trong đá vôi cũng quyết định chất lượng và ứng dụng của nó trong công nghiệp.
Cấu trúc tinh thể của đá vôi
Đá vôi có cấu trúc tinh thể đa dạng, phổ biến nhất là dạng khối lập phương và lục phương. Các tinh thể xếp chặt theo từng lớp tạo nên độ cứng đặc trưng.
Kinh nghiệm của tôi cho thấy việc quan sát mẫu đá vôi dưới kính hiển vi sẽ giúp học sinh hiểu rõ hơn về cấu trúc tinh thể này. Các tinh thể thường có kích thước từ vài micromet đến vài milimet.
Độ xếp chặt của tinh thể quyết định độ bền và khả năng chống phong hóa của đá vôi. Đây là yếu tố quan trọng khi sử dụng đá vôi trong xây dựng và công nghiệp.
Các phản ứng hóa học quan trọng của đá vôi
Đá vôi tham gia vào nhiều phản ứng của đá vôi quan trọng trong tự nhiên và công nghiệp. Các phản ứng này tạo ra nhiều sản phẩm có giá trị ứng dụng cao.
Phản ứng phân hủy nhiệt của đá vôi
Khi nung nóng đá vôi (CaCO3) ở nhiệt độ cao khoảng 900°C sẽ xảy ra đá vôi phân hủy thành vôi sống (CaO) và khí CO2:
CaCO3 → CaO + CO2 (∆H > 0)
Đây là phản ứng thu nhiệt, thường được thực hiện trong lò nung vôi công nghiệp. Vôi sống sinh ra được sử dụng rộng rãi trong xây dựng và công nghiệp.
Trong quá trình giảng dạy, tôi thường nhắc học sinh chú ý nhiệt độ phân hủy cao và tính thu nhiệt của phản ứng. Điều này giúp các em hiểu rõ điều kiện phản ứng.

Phản ứng của đá vôi với axit
Đá vôi phản ứng mạnh với các axit tạo muối canxi tương ứng, nước và khí CO2:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Phản ứng này xảy ra nhanh ở nhiệt độ thường, tạo bọt khí CO2 sủi mạnh. Đây là phản ứng đặc trưng để nhận biết đá vôi và cacbonat.
Kinh nghiệm cho thấy học sinh dễ nhớ phản ứng này qua hiện tượng sủi bọt khí rõ rệt khi nhỏ axit vào đá vôi.
Phản ứng tạo nước vôi trong
Vôi sống tác dụng với nước tạo thành nước vôi trong công thức Ca(OH)2:
CaO + H2O → Ca(OH)2
Phản ứng này tỏa nhiệt mạnh, tạo ra dung dịch trong suốt gọi là nước vôi trong. Nước vôi trong được sử dụng để thử CO2 và trong xây dựng.
Khi dạy phần này, tôi thường nhấn mạnh tính tỏa nhiệt của phản ứng và khuyến cáo học sinh cẩn thận khi thực hành.
Ứng dụng của đá vôi trong đời sống và công nghiệp
Đá vôi là một loại khoáng chất phổ biến với công thức đá vôi chính là CaCO3. Loại đá này có nhiều tính chất đặc biệt và ứng dụng đa dạng trong cuộc sống. Tương tự như công thức của tinh bột, đá vôi cũng đóng vai trò quan trọng trong nhiều lĩnh vực.
Sử dụng trong xây dựng
Đá vôi là nguyên liệu không thể thiếu trong ngành xây dựng. Khi nung ở nhiệt độ cao, đá vôi tạo thành vôi sống CaO – thành phần chính của xi măng. Quá trình này tương tự như công thức của thạch cao nung khi tạo ra vật liệu xây dựng.
Ngoài ra, đá vôi còn được sử dụng trực tiếp làm đá ốp lát, đá trang trí cho các công trình. Với độ bền cao và khả năng chống thấm tốt, đá vôi là lựa chọn hàng đầu của nhiều kiến trúc sư.
Ứng dụng trong nông nghiệp
Trong nông nghiệp, đá vôi tác dụng chủ yếu là điều chỉnh độ pH của đất. Bột đá vôi giúp trung hòa đất chua, tạo môi trường thuận lợi cho cây trồng phát triển.

Theo nghiên cứu của Viện Thổ nhưỡng Nông hóa, việc bón vôi đúng cách có thể tăng năng suất cây trồng lên 15-30%. Đặc biệt hiệu quả với các loại cây ưa đất kiềm như đậu, lạc.
Vai trò trong công nghiệp
Đá vôi đóng vai trò then chốt trong nhiều ngành công nghiệp. Trong luyện kim, đá vôi được dùng làm chất trợ dung để loại bỏ tạp chất.
Ngành công nghiệp hóa chất sử dụng đá vôi để sản xuất nhiều hợp chất quan trọng như soda, chlorine. Đá vôi cũng là nguyên liệu chính trong sản xuất thủy tinh, gốm sứ.
Trong xử lý môi trường, đá vôi được dùng để trung hòa nước thải công nghiệp và khử độc khí thải. Đây là giải pháp kinh tế và thân thiện với môi trường.
FAQ: Câu hỏi thường gặp về đá vôi
Đá vôi là một loại khoáng chất phổ biến trong tự nhiên. Tôi sẽ giải đáp một số thắc mắc thường gặp về loại đá này.
Đá vôi có công thức hóa học nào?
Thành phần chính của đá vôi là canxi cacbonat với công thức đá vôi là CaCO3. Đây là hợp chất vô cơ có cấu trúc tinh thể đặc trưng.
Ngoài CaCO3, đá vôi còn chứa một số tạp chất khác như silicat, oxit sắt và magie cacbonat. Tỷ lệ các tạp chất quyết định độ tinh khiết của đá vôi.
Trong quá trình giảng dạy, tôi thường nhắc học sinh ghi nhớ công thức này bằng cách liên tưởng: Ca (canxi) – C (cacbon) – O3 (3 nguyên tử oxi).
Làm thế nào để nhận biết đá vôi?
Đá vôi có màu trắng ngà hoặc xám nhạt đặc trưng. Bề mặt đá thường nhẵn mịn và có độ cứng vừa phải.
Cách đơn giản nhất để nhận biết đá vôi là cho tác dụng với dung dịch axit. Khi nhỏ vài giọt axit lên đá vôi, sẽ thấy hiện tượng sủi bọt do giải phóng khí CO2.
Trong phòng thí nghiệm, tôi thường hướng dẫn học sinh thực hiện phản ứng với HCl loãng để kiểm tra đá vôi một cách chính xác nhất.
Tại sao đá vôi lại tan trong axit?
Khi tiếp xúc với axit, đá vôi sẽ tham gia phản ứng hóa học theo phương trình:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Ion H+ từ axit sẽ phá vỡ liên kết trong CaCO3, tạo thành muối canxi tan trong nước và giải phóng khí CO2.
Đây là phản ứng một chiều, xảy ra nhanh ở nhiệt độ thường và là cơ sở để nhận biết đá vôi trong thực tế.
Kiến thức về công thức đá vôi CaCO3 là nền tảng quan trọng trong chương trình hóa học phổ thông. Đá vôi có cấu trúc tinh thể đặc trưng và tham gia vào nhiều phản ứng hóa học cơ bản như phân hủy nhiệt, tác dụng với axit. Việc nắm vững tính chất và phản ứng của đá vôi giúp ứng dụng hiệu quả trong xây dựng, nông nghiệp và công nghiệp.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

