Công thức cấu tạo của axit axetic và các dạng biểu diễn hóa học cơ bản
Công thức cấu tạo của axit axetic thể hiện đầy đủ cấu trúc phân tử và liên kết hóa học. Phân tử này có vai trò quan trọng trong công nghiệp và đời sống. Bài viết phân tích chi tiết các dạng biểu diễn công thức hóa học của axit axetic.
Công thức cấu tạo của axit axetic
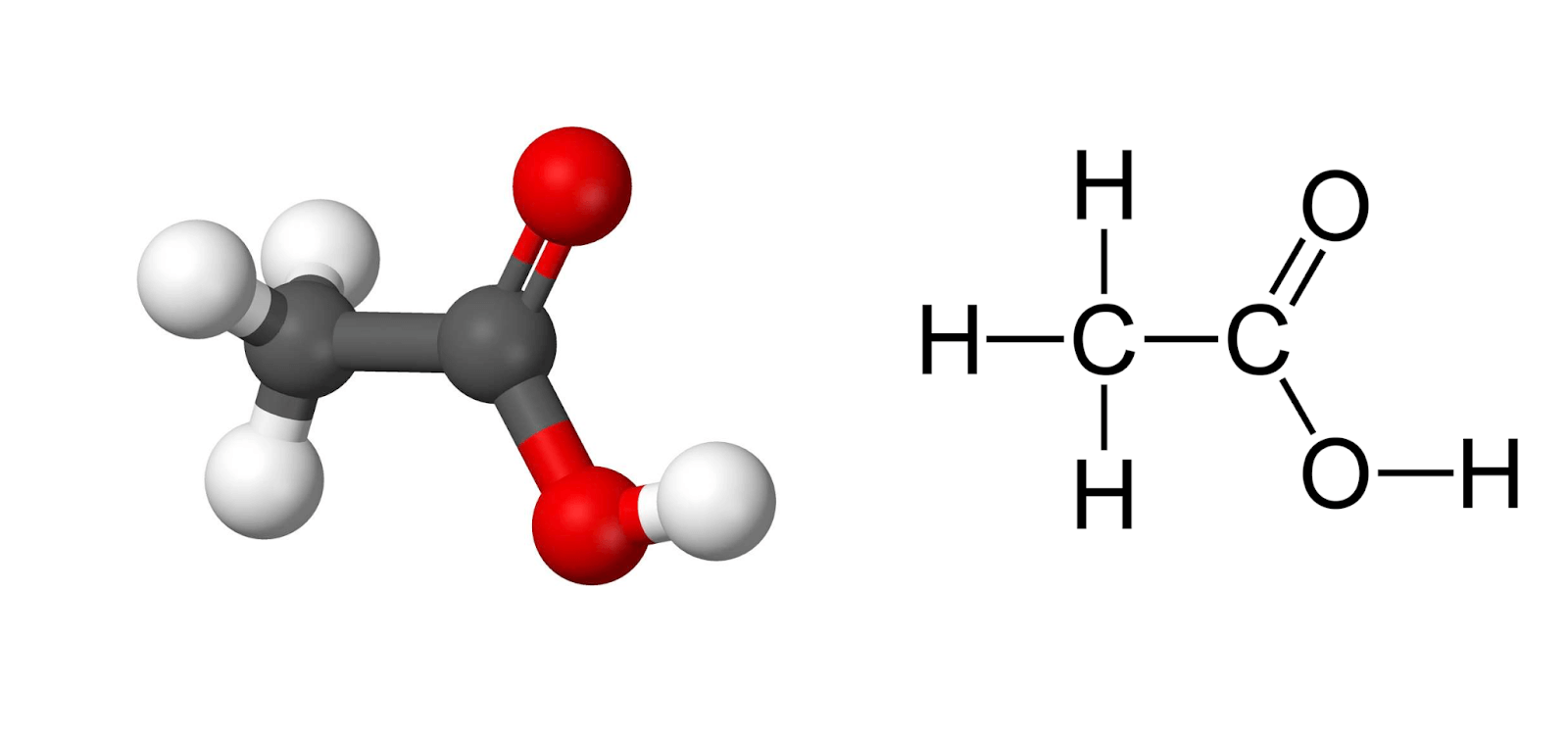
Axit axetic có công thức cấu tạo của axit axetic là CH3COOH. Đây là một axit hữu cơ đơn giản và phổ biến.
Công thức cấu tạo đầy đủ:
CH3-COOH
Trong đó:
– C
Là gốc metyl
– COOH: Là nhóm cacboxyl đặc trưng của axit cacboxylic
Khi vẽ công thức cấu tạo chi tiết, các liên kết giữa các nguyên tử được thể hiện rõ ràng:
“`
H O
| ||
H-C-C-O-H
|
H
“`
Trong quá trình giảng dạy, tôi thường giúp học sinh ghi nhớ công thức này bằng cách chia thành 2 phần: phần đuôi COOH luôn cố định và phần đầu CH3 thay đổi theo từng axit. Điều này giúp các em dễ dàng nhận biết và phân biệt với các axit cacboxylic khác.
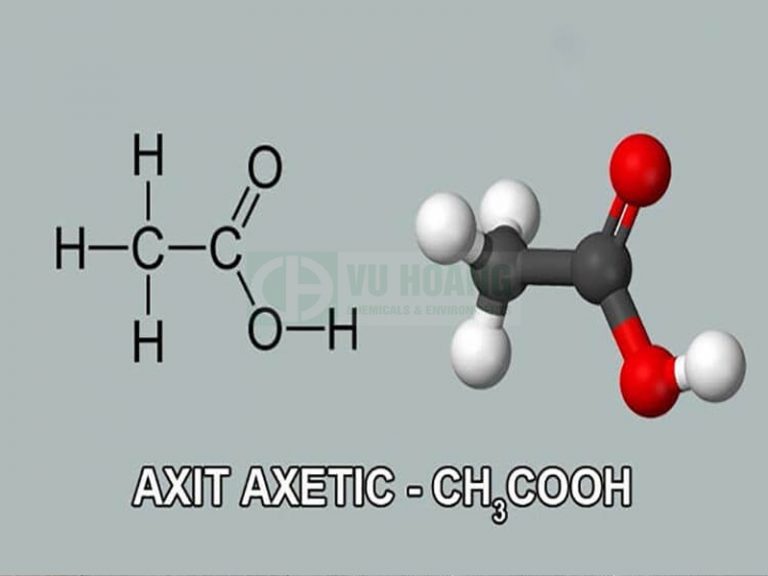
Khi viết phương trình phản ứng, các em có thể viết gọn CH3COOH hoặc CH3COOH tùy theo yêu cầu bài toán. Tuy nhiên cần lưu ý rằng cả hai cách viết đều thể hiện cùng một chất.
Tìm hiểu về axit axetic và các dạng biểu diễn công thức hóa học
Axit axetic là một trong những axit hữu cơ phổ biến nhất trong tự nhiên và đời sống. Chúng ta sẽ tìm hiểu chi tiết về hợp chất quan trọng này.
Axit axetic là gì và ứng dụng trong thực tế
Axit axetic là một axit hữu cơ đơn chức, có vị chua đặc trưng và mùi hăng nồng. Trong tự nhiên, axit axetic tồn tại dưới dạng dung dịch trong giấm ăn với nồng độ khoảng 4-8%.
Trong công nghiệp, axit axetic được sản xuất với số lượng lớn làm nguyên liệu cho nhiều ngành. Tôi thường lấy ví dụ về việc sản xuất nhựa PVA và các loại sơn công nghiệp cho học sinh dễ hình dung.
Trong đời sống, axit axetic có mặt trong nhiều sản phẩm quen thuộc như giấm ăn, nước muối chua và các loại gia vị. Nó cũng được dùng làm chất bảo quản thực phẩm hiệu quả.
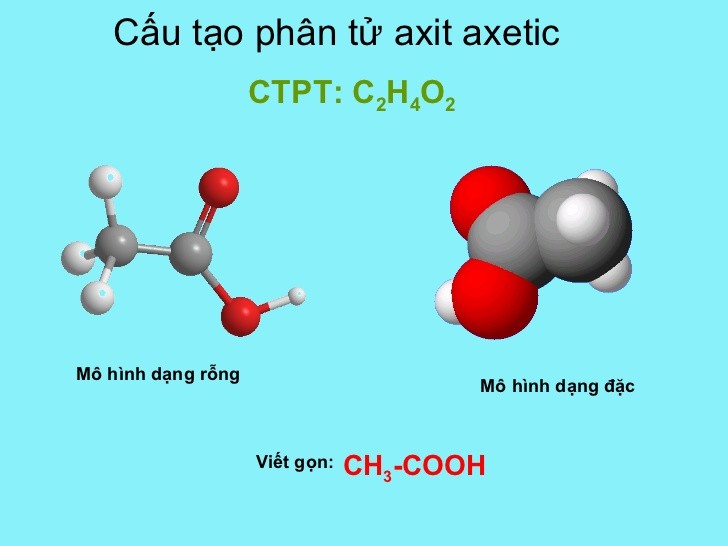
Công thức phân tử của axit axetic
Công thức phân tử của axit axetic là C2H4O2. Công thức này cho biết trong một phân tử axit axetic có:
– 2 nguyên tử cacbon (C)
– 4 nguyên tử hiđro (H)
– 2 nguyên tử oxi (O)
Khi giảng dạy, tôi thường nhắc học sinh ghi nhớ công thức này bằng cách liên hệ với công thức cấu tạo của rượu etylic vì chúng có cùng số nguyên tử C.
Công thức cấu tạo thu gọn của axit axetic
Công thức cấu tạo thu gọn của axit axetic là CH3COOH. Đây là cách viết ngắn gọn thể hiện sự liên kết giữa các nguyên tử trong phân tử.
Trong công thức này, nhóm CH3- gắn với nhóm -COOH tạo thành cấu trúc đặc trưng của axit axetic. Nhóm -COOH chính là nhóm chức axit carboxylic, quyết định tính chất hóa học của hợp chất.
Khi dạy về công thức này, tôi thường vẽ mô hình phân tử để học sinh hình dung rõ vị trí các nguyên tử trong không gian 3 chiều.
Phân tích chi tiết công thức cấu tạo của axit axetic
Axit axetic có công thức cấu tạo của axit axetic là CH3COOH. Đây là một axit carboxylic đơn giản nhất sau axit formic.
Phân tử axit axetic có cấu trúc phẳng với nhóm carboxyl (-COOH) và nhóm methyl (-CH3). Cấu trúc này giúp phân tử có khả năng phân ly proton và tạo liên kết hydro.
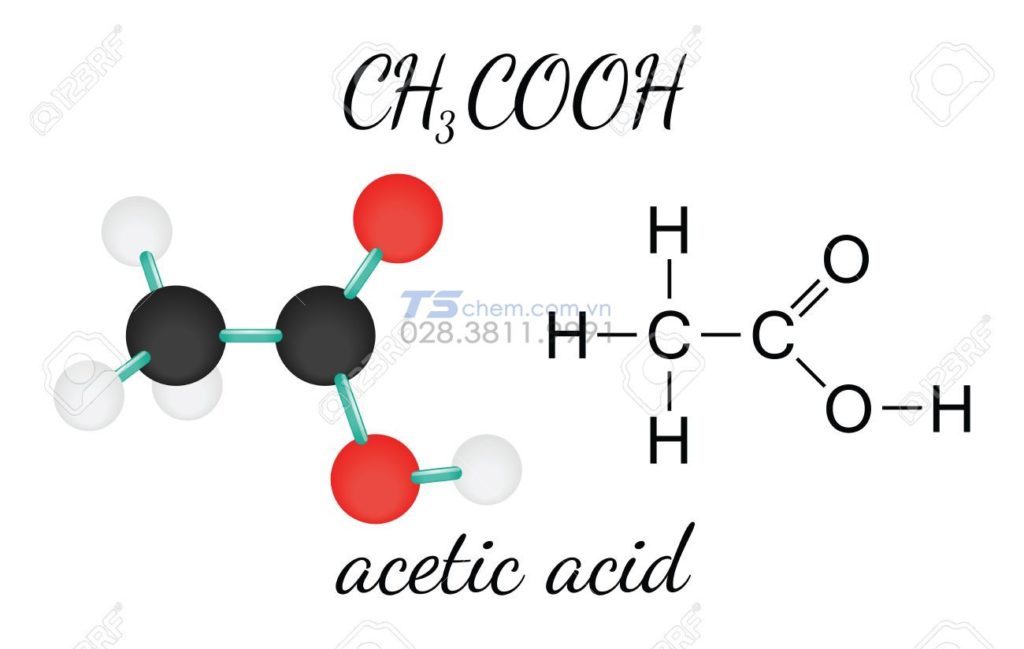
Tương tự như công thức cấu tạo của axetilen, axit axetic cũng có cấu trúc đặc trưng. Nó là nguyên liệu quan trọng để tổng hợp vinyl axetat là gì.
Cấu tạo phân tử và liên kết trong axit axetic
Trong phân tử axit axetic, nguyên tử carbon trung tâm của nhóm carboxyl có cấu hình sp2. Góc liên kết giữa các nguyên tử là 120°.
Liên kết C=O có tính chất liên kết đôi, với một liên kết σ và một liên kết π. Nhóm -OH gắn với carbon carboxyl tạo ra khả năng phân ly proton.
Nhóm methyl (-CH3) có cấu hình sp3 với góc liên kết xấp xỉ 109,5°. Các liên kết C-H trong nhóm methyl đều là liên kết đơn.
Công thức electron của axit axetic
Axit axetic công thức electron thể hiện rõ sự phân bố các electron hóa trị. Mỗi nguyên tử carbon đều tuân theo quy tắc octet.
Carbon carboxyl có 3 liên kết hóa trị và một cặp electron tự do. Carbon methyl tạo 4 liên kết đơn với 3 nguyên tử hydro và carbon carboxyl.
Oxygen carbonyl có 2 liên kết (1 đôi, 1 đơn) và 2 cặp electron tự do. Oxygen hydroxyl có 2 liên kết đơn và 2 cặp electron tự do.
Công thức Lewis của axit axetic
Axit axetic công thức lewis biểu diễn đầy đủ các electron hóa trị bằng chấm hoặc gạch ngang. Mỗi electron được thể hiện bằng một chấm.
Trong công thức Lewis, các cặp electron tự do được biểu diễn bằng 2 chấm. Liên kết đơn được biểu diễn bằng một gạch ngang.
Liên kết đôi C=O được biểu diễn bằng 2 gạch ngang song song. Công thức Lewis giúp dễ dàng theo dõi sự chuyển dịch electron trong phản ứng.
Các dạng biểu diễn không gian và cấu trúc 3D của axit axetic
Axit axetic là một trong những axit carboxylic đơn giản nhất và phổ biến nhất trong tự nhiên. Cấu trúc không gian của phân tử này có vai trò quan trọng quyết định tính chất vật lý và hóa học của nó.
Để hiểu rõ hơn về axit axetic công thức không gian, ta cần phân tích chi tiết cấu trúc 3D của phân tử. Điều này giúp giải thích nhiều tính chất đặc trưng như khả năng tạo liên kết hydro hay phản ứng este hóa, tương tự như công thức của axit oleic.
Công thức không gian của axit axetic
Công thức không gian của axit axetic có dạng tứ diện méo. Nhóm carboxyl -COOH nằm ở một đầu và nhóm methyl -CH3 nằm ở đầu còn lại của phân tử.
Trong đó, nguyên tử carbon sp3 của nhóm methyl liên kết với 3 nguyên tử hydro và 1 nguyên tử carbon sp2 của nhóm carboxyl. Các liên kết này tạo thành hình tứ diện đều với góc liên kết xấp xỉ 109.5°.
Nhóm carboxyl có cấu trúc phẳng do carbon sp2 tạo liên kết π với oxygen. Điều này làm cho phân tử có khả năng phân cực mạnh và dễ dàng tham gia phản ứng.
Cấu hình và góc liên kết trong phân tử
Góc liên kết trong phân tử axit axetic được xác định bởi lai hóa của các orbital nguyên tử:
– Góc H-C-H trong nhóm methyl: 109.5°
– Góc O=C-O trong nhóm carboxyl: 123°
– Góc C-C-O giữa nhóm methyl và carboxyl: 115°
Cấu trúc này cho phép phân tử có độ linh động cao trong không gian. Nhóm -OH có thể xoay tự do quanh liên kết đơn C-O, tạo điều kiện thuận lợi cho việc hình thành liên kết hydro giữa các phân tử.
Sự sắp xếp không gian này cũng giải thích tại sao axit axetic có nhiệt độ sôi cao hơn so với các hydrocarbon có khối lượng phân tử tương đương.
Phản ứng hóa học đặc trưng của axit axetic
Axit axetic với công thức axit axetic CH3COOH là một axit hữu cơ phổ biến. Phân tử này có axit axetic dạng phân tử là C2H4O2 và axit axetic dạng cấu tạo thể hiện rõ nhóm -COOH.
Trong môi trường nước, axit axetic phân ly thành ion H+ và CH3COO-. Đây là cơ sở cho các phản ứng đặc trưng của axit axetic với bazơ và rượu.
Phản ứng với bazơ tạo muối
Khi tác dụng với bazơ, axit axetic tạo ra muối axetat và nước. Phản ứng này tuân theo quy luật trung hòa axit – bazơ.
Ví dụ với NaOH:
CH3COOH + NaOH → CH3COONa + H2O
Muối axetat sinh ra có nhiều ứng dụng quan trọng trong công nghiệp và đời sống. Bạn có thể tìm hiểu thêm về công thức hóa học của muối để nắm vững kiến thức này.
Phản ứng với rượu tạo este
Axit axetic phản ứng với rượu (ancol) tạo thành este và nước. Đây là phản ứng este hóa điển hình.
Phương trình tổng quát:
CH3COOH + R-OH ⇌ CH3COOR + H2O
Phản ứng este hóa là phản ứng thuận nghịch, cần xúc tác axit và đun nóng để tăng hiệu suất. Sản phẩm este thường có mùi thơm đặc trưng của hoa quả.
Trong quá trình giảng dạy, tôi thường cho học sinh thực hành phản ứng giữa axit axetic với etanol để tạo etyl axetat có mùi thơm của chuối chín.
FAQ: Câu hỏi thường gặp về axit axetic
Axit axetic là một trong những hợp chất hữu cơ phổ biến nhất trong đời sống. Tôi thường nhận được nhiều câu hỏi từ học sinh về hợp chất này.
Khi nghiên cứu về axit axetic, các bạn cần nắm vững công thức cấu tạo của fructozơ để hiểu rõ hơn về phản ứng giữa các hợp chất hữu cơ. công thức cấu tạo của fructozơ giúp bạn dễ dàng phân biệt với các đồng phân khác.
Trong quá trình giảng dạy, tôi thường lấy ví dụ về công thức đimetylamin để minh họa sự khác biệt giữa amin và axit hữu cơ. công thức đimetylamin là gì là một ví dụ điển hình về amin bậc hai.
Khi học sinh hỏi về phản ứng của axit axetic, tôi thường so sánh với công thức cấu tạo C3H6 để giải thích về cơ chế phản ứng. công thức cấu tạo c3h6 là một alkene đơn giản giúp hiểu rõ hơn về liên kết đôi.
Qua 20 năm giảng dạy, tôi nhận thấy việc kết nối kiến thức giữa các hợp chất hữu cơ giúp học sinh hiểu sâu sắc hơn về bản chất của phản ứng hóa học.
Việc nắm vững công thức cấu tạo của axit axetic giúp học sinh hiểu rõ bản chất và tính chất của hợp chất quan trọng này. Các dạng biểu diễn từ công thức phân tử đến công thức Lewis và không gian cho thấy cấu trúc phức tạp của phân tử axit axetic. Kiến thức này tạo nền tảng để học sinh nghiên cứu sâu hơn về các phản ứng hóa học đặc trưng của axit axetic trong thực tế.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

