Công thức tính khối lượng mol và cách áp dụng trong bài tập hóa học cơ bản
Công thức tính khối lượng mol giúp xác định chính xác lượng chất trong phản ứng hóa học. Bài viết trình bày chi tiết các phương pháp tính toán mol từ khối lượng và thể tích. Các ví dụ thực tế kèm bài tập giúp học sinh nắm vững kiến thức cơ bản này.
Công thức tính khối lượng mol và ý nghĩa trong hóa học
Khối lượng mol là khối lượng tính bằng gam của 1 mol chất. Đây là một khái niệm quan trọng giúp tính toán chính xác lượng chất trong phản ứng hóa học.
Công thức tính khối lượng mol được xác định bằng công thức:
M = m/n
Trong đó:
– M: Khối lượng mol (g/mol)
– m: Khối lượng chất (g)
– n: Số mol chất (mol)
Qua 20 năm giảng dạy, tôi nhận thấy học sinh thường nhầm lẫn giữa khối lượng mol và mol trong hóa học. Mol là đơn vị đo lượng chất, còn khối lượng mol cho biết 1 mol chất nặng bao nhiêu gam.

Ví dụ: Tính khối lượng mol của NaCl
– Cho m(NaCl) = 11,7g và n = 0,2 mol
– Áp dụng công thức: M = 11,7/0,2 = 58,5 g/mol
Khi tính toán các bài tập về nồng độ dung dịch, công thức tính phần trăm thể tích và khối lượng mol thường đi đôi với nhau. Việc nắm vững công thức này giúp giải quyết nhiều dạng bài tập phức tạp.
Một mẹo nhỏ tôi hay chia sẻ với học sinh: Khối lượng mol của một hợp chất bằng tổng khối lượng nguyên tử của các nguyên tố cấu thành nó. Điều này giúp kiểm tra nhanh kết quả tính toán.
Khái niệm cơ bản về mol và số Avogadro trong hóa học
Mol và số Avogadro là hai khái niệm nền tảng trong hóa học. Chúng giúp các nhà khoa học đo lường chính xác số lượng nguyên tử, phân tử trong phản ứng hóa học.
Khi nghiên cứu về cấu trúc phân tử, việc hiểu rõ mol và số avogadro sẽ giúp tính toán chính xác số liên kết trong phân tử. Điều này đặc biệt quan trọng khi công thức tính số liên kết pi được áp dụng.
Định nghĩa mol và vai trò trong phản ứng hóa học
Mol là đơn vị đo lường số lượng hạt trong hệ SI. Một mol chất chứa đúng 6,022 x 10^23 hạt.
Trong phản ứng hóa học, mol giúp xác định tỉ lệ phản ứng giữa các chất. Ví dụ khi 1 mol H2 phản ứng với 1 mol O2 sẽ tạo ra 2 mol H2O.
Khối lượng mol là gì? Đó chính là khối lượng tính bằng gam của 1 mol chất, bằng tổng khối lượng nguyên tử của các nguyên tố cấu thành.
Mối quan hệ giữa mol và số Avogadro
Số Avogadro (NA = 6,022 x 10^23) thể hiện số hạt có trong 1 mol chất. Đây là hằng số cơ bản trong hóa học.
Mối quan hệ này được biểu diễn qua công thức:
n = N/NA
Trong đó:
– n: số mol
– N: số hạt
– NA: số Avogadro
Việc chuyển đổi giữa số mol và số hạt dựa trên công thức này rất quan trọng trong tính toán hóa học.
Các đơn vị đo lường liên quan đến mol
Đơn vị đo mol liên quan chặt chẽ với khối lượng và thể tích. Công thức quan trọng cần nhớ:
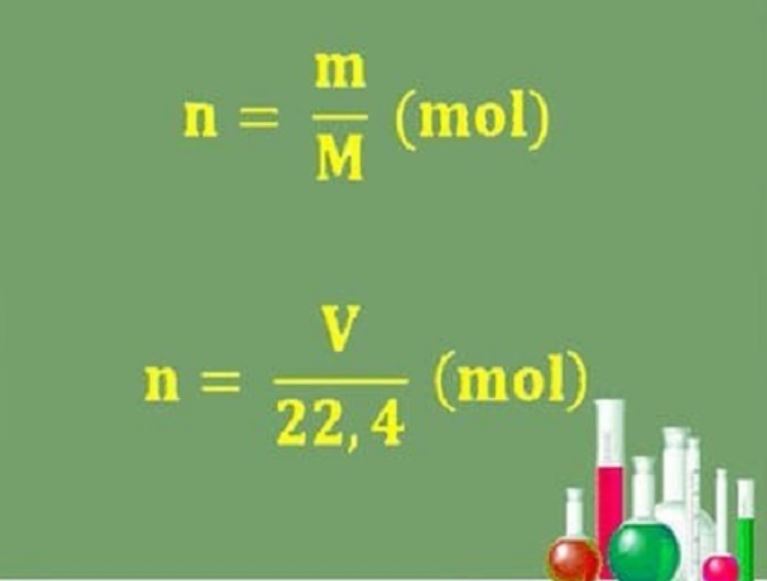
M = m/n
Trong đó:
– M: khối lượng mol (g/mol)
– m: khối lượng chất (g)
– n: số mol
Với chất khí ở điều kiện tiêu chuẩn:
V = n × 22,4
Trong đó:
– V: thể tích khí (lít)
– n: số mol
– 22,4: thể tích mol khí lý tưởng (lít/mol)
Các công thức tính mol cơ bản và ứng dụng
Mol là đơn vị đo lường số lượng hạt trong hóa học. Việc nắm vững công thức tính mol giúp giải quyết nhiều bài toán hóa học phức tạp.
Có 3 cách tính mol phổ biến từ khối lượng, thể tích khí và nồng độ dung dịch. Mỗi cách có công thức và ứng dụng riêng.

Công thức tính mol từ khối lượng chất
Công thức cơ bản:
n = m/M
Trong đó:
– n: số mol (mol)
– m: khối lượng chất (g)
– M: khối lượng mol (g/mol)
Ví dụ: Tính số mol của 40g NaOH (M = 40 g/mol)
n = 40/40 = 1 mol NaOH
Khi giảng dạy, tôi thường nhắc học sinh kiểm tra đơn vị trước khi áp dụng công thức tính tỉ khối.
Công thức tính mol từ thể tích khí
Công thức:
n = V/22,4
Trong đó:
– n: số mol (mol)
– V: thể tích khí ở đktc (lít)
– 22,4: thể tích mol khí ở đktc (lít/mol)
Cách tính số mol này chỉ áp dụng cho khí ở điều kiện tiêu chuẩn. Với điều kiện khác, cần quy đổi về đktc.
Kinh nghiệm của tôi là học sinh thường nhầm lẫn đơn vị thể tích, cần chú ý quy đổi về lít.
Công thức tính mol từ nồng độ dung dịch
Công thức:
n = C.V
Trong đó:
– n: số mol (mol)
– C: nồng độ mol/lít (M)
– V: thể tích dung dịch (lít)
Khối lượng mol của chất tan có thể tính ngược lại từ số mol. Học sinh cần nắm vững công thức tính nồng độ dung dịch.
Tôi thường cho học sinh làm bài tập theo nhóm để hiểu rõ mối liên hệ giữa các đại lượng.
Hướng dẫn chuyển đổi đơn vị mol trong hóa học
Việc chuyển đổi đơn vị mol là kỹ năng quan trọng trong học tập và giải bài tập hóa học. Tôi sẽ hướng dẫn chi tiết các phương pháp chuyển đổi phổ biến nhất.
Trước khi đi vào chi tiết, cần nắm vững mối quan hệ giữa mol và khối lượng cũng như thể tích của chất. Điều này giúp việc tính toán chính xác hơn.

Chuyển đổi từ mol sang gam
Công thức chuyển đổi cơ bản:
m = n × M
Trong đó:
– m là khối lượng (gam)
– n là số mol
– M là khối lượng mol (g/mol)
Ví dụ: Tính khối lượng của 2 mol NaCl. Tra bảng công thức hóa học của muối, ta có M(NaCl) = 58,5 g/mol.
Áp dụng công thức: m = 2 × 58,5 = 117 gam
Chuyển đổi từ mol sang thể tích khí
Công thức chuyển đổi mol sang thể tích khí:
V = n × Vm
Trong đó:
– V là thể tích khí (lít)
– n là số mol
– Vm là thể tích mol (22,4 L/mol ở đktc)
Khi tính toán với khí thực tế, cần điều chỉnh theo phương trình trạng thái khí lý tưởng PV = nRT.
Các lưu ý khi chuyển đổi đơn vị
Khi chuyển đổi đơn vị mol, một số điểm cần chú ý:
Luôn kiểm tra điều kiện nhiệt độ và áp suất khi làm việc với khí. Điều kiện tiêu chuẩn khác với điều kiện thường.
Với chất rắn và lỏng, khối lượng riêng không phụ thuộc nhiệt độ và áp suất như khí. Việc chuyển đổi đơn giản hơn.
Khi làm việc với dung dịch, nồng độ mol/lít (M) là đại lượng thường gặp. Công thức liên hệ: C = n/V.
Bài tập thực hành về tính toán mol
Việc tính toán mol là kỹ năng quan trọng trong hóa học. Tôi sẽ hướng dẫn các em giải quyết các bài tập tính mol thông qua nhiều dạng bài khác nhau.
Trước khi đi vào chi tiết, các em cần nắm vững công thức tính số mol cơ bản:
n = m/M (với m là khối lượng chất và M là khối lượng mol)
n = V/22,4 (với V là thể tích khí ở điều kiện tiêu chuẩn)
Bài tập tính mol từ khối lượng chất
Khi giải bài tập dạng này, các em cần xác định rõ khối lượng chất cho trước và khối lượng mol của chất.
Ví dụ: Tính số mol của 40g NaOH
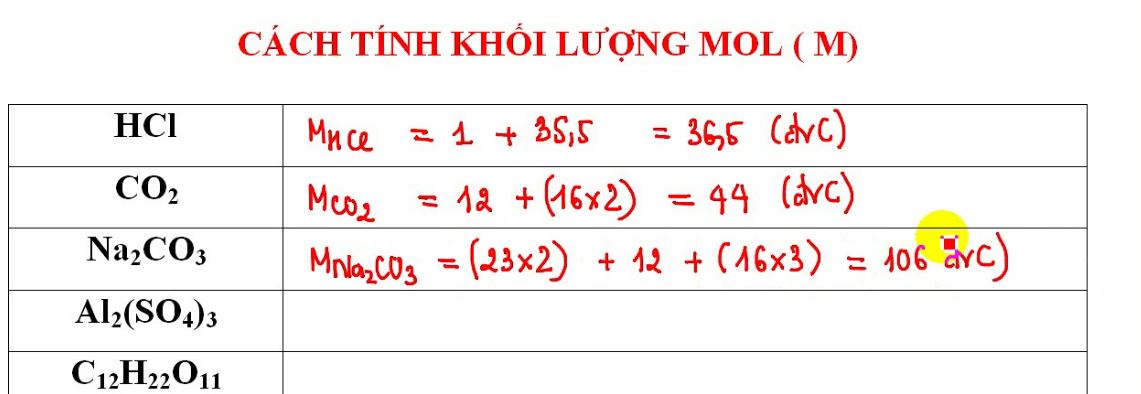
– Bước 1: Xác định M(NaOH) = 23 + 16 + 1 = 40 (g/mol)
– Bước 2: Áp dụng công thức n = m/M = 40/40 = 1 mol
Một mẹo nhỏ tôi thường chia sẻ với học sinh là hãy kiểm tra đơn vị của kết quả. Nếu không phải mol thì chắc chắn đã tính sai.
Bài tập tính mol từ thể tích khí
1. Tốc độ phản ứng hóa học là gì… có ảnh hưởng trực tiếp đến thể tích khí sinh ra, từ đó ảnh hưởng đến cách tính số mol.
Với khí ở điều kiện tiêu chuẩn, ta áp dụng:
n = V/22,4 (V tính bằng lít)
Ví dụ: Tính số mol của 44,8 lít khí CO2 (đktc)
n = 44,8/22,4 = 2 mol
Bài tập tổng hợp về mol
Dạng bài này thường kết hợp nhiều phương pháp tính mol khác nhau. Tôi thường khuyên học sinh:
– Đọc kỹ đề bài, gạch chân thông tin quan trọng
– Xác định rõ đơn vị đo của các đại lượng
– Chọn công thức phù hợp với từng trường hợp
Ví dụ: Cho 5,6 lít khí N2 (đktc) tác dụng với 4g H2. Tính mol từ khối lượng H2 và thể tích N2 để tìm chất giới hạn.
Cách giải:
n(N2) = 5,6/22,4 = 0,25 mol
n(H2) = 4/2 = 2 mol
FAQ: Câu hỏi thường gặp về tính toán mol
Các câu hỏi về tính toán mol luôn khiến nhiều học sinh đau đầu. Tôi sẽ giải đáp những thắc mắc phổ biến nhất sau 20 năm giảng dạy môn hóa.
Làm sao để nhớ công thức tính mol?
Cách tốt nhất để nhớ công thức tính mol là liên hệ với thực tế. Tôi thường ví mol như một “túi” đựng nguyên tử hoặc phân tử.
Mỗi mol chứa 6,02.10^23 hạt, giống như mỗi tá trứng có 12 quả. Con số này được gọi là số Avogadro.
Công thức cơ bản cần nhớ:
n = m/M
Trong đó:
– n là số mol (mol)
– m là khối lượng chất (g)
– M là khối lượng mol (g/mol)
Tại sao cần học về mol trong hóa học?
Mol là đơn vị cơ bản để tính toán số lượng chất trong phản ứng hóa học. Nó giúp xác định tỉ lệ phản ứng chính xác.
Khi làm thí nghiệm, chúng ta không thể đếm từng nguyên tử. Mol giúp quy đổi từ khối lượng sang số hạt.
Trong công nghiệp hóa chất, mol là cơ sở để tính toán nguyên liệu cần thiết cho sản xuất quy mô lớn.
Các sai lầm thường gặp khi tính mol
Sai lầm phổ biến nhất là nhầm lẫn giữa khối lượng mol và số mol. Khối lượng mol là đặc trưng của chất, còn số mol là số lượng chất.
Học sinh thường quên đổi đơn vị khi tính toán. Cần đảm bảo khối lượng tính bằng gam, khối lượng mol tính bằng gam/mol.
Một lỗi nghiêm trọng khác là áp dụng sai công thức cho từng dạng bài. Tôi khuyên các em nên phân loại bài tập và ghi chú công thức phù hợp.
Việc áp dụng công thức tính khối lượng mol đóng vai trò then chốt trong tính toán hóa học. Các công thức mol giúp xác định chính xác lượng chất tham gia phản ứng và tạo nền tảng cho việc cân bằng phương trình. Thông qua việc nắm vững cách chuyển đổi đơn vị và áp dụng số Avogadro, người học có thể giải quyết các bài toán về mol một cách dễ dàng. Các ví dụ thực tế và bài tập minh họa là công cụ hữu ích để rèn luyện kỹ năng tính toán mol trong hóa học.
Bài viết liên quan
Tổng quan công thức Faraday hóa và ứng dụng trong điện phân
Tìm hiểu chi tiết về công thức Faraday hóa học trong điện phân, cách áp dụng định luật và giải bài tập với phương pháp đơn giản. Hướng dẫn tính toán khối lượng chất điện phân chuẩn xác.

Thông tin chi tiết về công thức tỉ khối và cách áp dụng trong hóa học
Tìm hiểu công thức tỉ khối và cách áp dụng trong hóa học. Bài viết giải thích chi tiết các loại tỉ khối, phương pháp xác định và bài tập thực hành cho học sinh dễ hiểu.

Tổng quan công thức tính nồng độ đương lượng và cách áp dụng
Tìm hiểu chi tiết công thức tính nồng độ đương lượng, cách xác định đương lượng gam và giải bài tập với phương pháp đơn giản. Bao gồm công thức, ví dụ và bài tập mẫu có lời giải.
Tổng quan công thức tính số liên kết hóa trị và cách áp dụng chuẩn xác
Hướng dẫn công thức tính số liên kết hóa trị và phương pháp xác định chính xác các loại liên kết trong phân tử hữu cơ. Giải thích chi tiết cách tính liên kết σ, π kèm bài tập minh họa.
Phân tích công thức tính liên kết hidro và ứng dụng trong hóa học
Tìm hiểu công thức tính liên kết hidro và cách áp dụng trong các phân tử, gen, protein. Giải thích chi tiết bản chất, vai trò quan trọng trong nước, rượu và axit nucleic.

Công thức tính đồng phân và cách xác định nhanh các dạng đồng phân hóa học
Tìm hiểu công thức tính đồng phân và phương pháp xác định nhanh số đồng phân trong hóa học. Hướng dẫn chi tiết cách tính đồng phân ankan, ancol kèm bài tập và mẹo giải nhanh cho học sinh.

