Công thức tính biến thiên enthalpy và cách xác định nhiệt phản ứng chuẩn
Công thức tính biến thiên enthalpy giúp xác định năng lượng trao đổi trong phản ứng hóa học. Các phản ứng tỏa nhiệt và thu nhiệt đều tuân theo quy luật bảo toàn năng lượng. Enthalpy đóng vai trò quan trọng trong việc dự đoán chiều hướng của phản ứng hóa học.
Công thức tính biến thiên enthalpy trong phản ứng hóa học
Biến thiên enthalpy là một khái niệm quan trọng trong nhiệt động lực học. Nó cho biết nhiệt lượng trao đổi giữa hệ và môi trường trong một phản ứng hóa học.
Công thức tính biến thiên enthalpy được biểu diễn như sau:
ΔH = ΣH(sản phẩm) – ΣH(chất phản ứng)
Trong đó:
– ΔH: Biến thiên enthalpy của phản ứng (kJ/mol)
– ΣH(sản phẩm): Tổng enthalpy của các sản phẩm
– ΣH(chất phản ứng): Tổng enthalpy của các chất phản ứng
Qua 20 năm giảng dạy, tôi nhận thấy học sinh thường nhầm lẫn dấu của ΔH. Nếu ΔH < 0, phản ứng tỏa nhiệt. Nếu ΔH > 0, phản ứng thu nhiệt.
Ví dụ minh họa:
CH4 + 2O2 → CO2 + 2H2O
ΔH = [-394 + 2(-286)] – [-75 + 2(0)] = -891 kJ/mol
Phản ứng trên có ΔH âm nên là phản ứng tỏa nhiệt. Điều này giải thích vì sao khi đốt khí metan (CH4) sẽ tạo ra nhiệt lượng.

Một mẹo nhỏ giúp ghi nhớ: Hãy tưởng tượng enthalpy như “năng lượng trong ví”. Nếu ví nhẹ đi (ΔH < 0) tức là đã chi tiêu (tỏa nhiệt). Nếu ví nặng thêm (ΔH > 0) tức là được nạp tiền (thu nhiệt).
Khái niệm và định nghĩa biến thiên enthalpy trong hóa học
Biến thiên enthalpy trong hóa học là sự thay đổi năng lượng của hệ khi xảy ra phản ứng hóa học ở áp suất không đổi. Đây là một đại lượng nhiệt động học quan trọng giúp xác định nhiệt lượng trao đổi giữa hệ và môi trường.

Khi nghiên cứu về nhiệt hóa học, tôi thường giải thích cho học sinh bằng ví dụ đơn giản về nồi cơm điện. Khi nấu cơm, nhiệt năng được truyền từ môi trường (điện trở) vào hệ (gạo và nước), làm biến đổi trạng thái của hệ.
Biến thiên enthalpy là gì và ý nghĩa
Biến thiên enthalpy là gì? Đó chính là hiệu số giữa enthalpy của sản phẩm và enthalpy của chất phản ứng. Công thức tổng quát:
ΔH = H(sản phẩm) – H(chất phản ứng)
Giá trị ΔH âm (-) cho biết phản ứng tỏa nhiệt, nghĩa là hệ nhường nhiệt cho môi trường. Ngược lại, ΔH dương (+) chỉ phản ứng thu nhiệt, tức hệ hấp thụ nhiệt từ môi trường.
Enthalpy tiêu chuẩn và điều kiện áp dụng
Enthalpy tiêu chuẩn được đo ở điều kiện nhiệt độ 298K (25°C) và áp suất 1 atm. Đây là điều kiện chuẩn để so sánh các giá trị enthalpy giữa các phản ứng khác nhau.
Trong quá trình giảng dạy, tôi luôn nhấn mạnh với học sinh rằng enthalpy tiêu chuẩn giống như “thước đo chuẩn” để đánh giá mức độ tỏa nhiệt hay thu nhiệt của phản ứng.
Vai trò của enthalpy trong phản ứng hóa học
Enthalpy đóng vai trò then chốt trong việc dự đoán khả năng xảy ra tự phát của phản ứng hóa học. Nó giúp các nhà khoa học tính toán hiệu suất năng lượng của quá trình.
Từ kinh nghiệm 20 năm giảng dạy, tôi nhận thấy học sinh thường hiểu sai về mối quan hệ giữa enthalpy và tốc độ phản ứng. Enthalpy chỉ cho biết nhiệt lượng trao đổi chứ không quyết định tốc độ phản ứng diễn ra nhanh hay chậm.
Việc nắm vững khái niệm enthalpy giúp dự đoán được chiều hướng của phản ứng và lượng nhiệt trao đổi, từ đó có thể điều khiển phản ứng theo hướng có lợi.
Cách tính biến thiên enthalpy và nhiệt phản ứng
Biến thiên enthalpy và nhiệt phản ứng là hai đại lượng quan trọng trong hóa học. Chúng giúp xác định năng lượng trao đổi trong phản ứng.
Để tính chính xác các đại lượng này, ta cần nắm vững các công thức tính biến thiên enthalpy và áp dụng đúng phương pháp. Tôi sẽ hướng dẫn chi tiết từng bước.
Công thức tính ΔH cơ bản
Công thức tổng quát tính ΔH:
ΔH = ΣΔHf(sản phẩm) – ΣΔHf(reactant)
Trong đó:
– ΔHf: Enthalpy tạo thành chuẩn
– Σ: Tổng các enthalpy
Khi giảng dạy, tôi thường nhắc học sinh phải chú ý dấu của các enthalpy. Sản phẩm luôn mang dấu dương, còn chất phản ứng mang dấu âm.
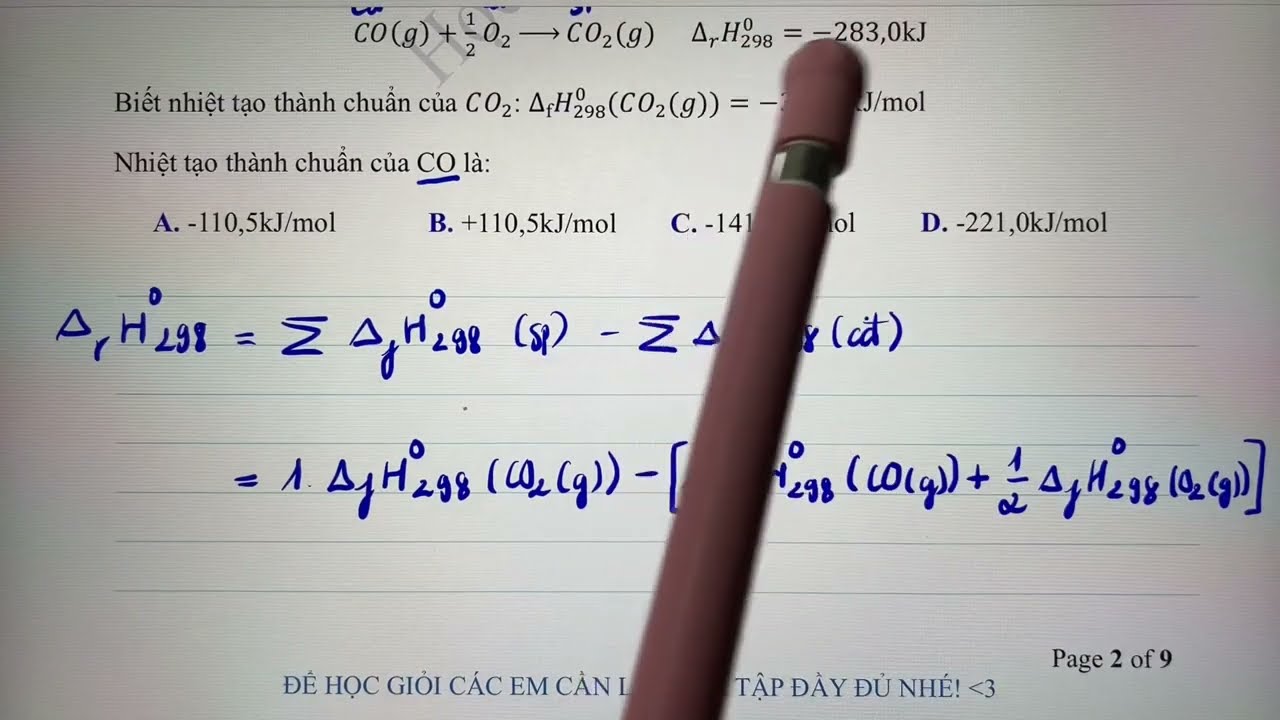
Phương pháp tính nhiệt phản ứng từ ΔH
Cách tính nhiệt phản ứng dựa trên biến thiên enthalpy theo công thức:
Q = -ΔH (với Q là nhiệt phản ứng)
Nếu ΔH > 0: Phản ứng thu nhiệt
Nếu ΔH < 0: Phản ứng tỏa nhiệt
Kinh nghiệm của tôi là học sinh cần ghi nhớ quy ước dấu này. Nó giúp xác định đúng bản chất của phản ứng.
Ví dụ minh họa và bài tập áp dụng
Ví dụ: Tính nhiệt phản ứng của phản ứng cháy C
CH4 + 2O2 → CO2 + 2H2O
Cho:
ΔHf(CH4) = -74,85 kJ/mol
ΔHf(CO2) = -393,5 kJ/mol
ΔHf(H2O) = -285,8 kJ/mol
Áp dụng công thức:
ΔH = [-393,5 + 2(-285,8)] – [-74,85]
ΔH = -890,25 kJ/mol
Để nâng cao hiệu quả học tập, các bạn có thể tham khảo thêm công thức tính hiệu suất phản ứng, hiệu suất phản ứng hóa học là gì.
Phân loại phản ứng theo biến thiên enthalpy
Phản ứng hóa học luôn đi kèm với sự biến đổi năng lượng. Biến thiên enthalpy âm dương giúp phân loại phản ứng thành hai nhóm chính.
Enthalpy là đại lượng nhiệt động học quan trọng. Nó cho biết năng lượng trao đổi giữa hệ và môi trường.
Phản ứng tỏa nhiệt với ΔH âm
Phản ứng tỏa nhiệt hấp nhiệt xảy ra khi hệ giải phóng năng lượng ra môi trường. Giá trị ΔH mang dấu âm (-).
Ví dụ điển hình là phản ứng cháy của nhiên liệu:
CH4 + 2O2 → CO2 + 2H2O (ΔH = -890 kJ/mol)
Trong quá trình giảng dạy, tôi thường ví von phản ứng tỏa nhiệt như việc cho tiền – số tiền giảm đi nên mang dấu âm.
Phản ứng thu nhiệt với ΔH dương
Ngược lại, phản ứng thu nhiệt hấp thụ năng lượng từ môi trường. ΔH mang dấu dương (+).
Quá trình quang hợp là ví dụ tiêu biểu:
6CO2 + 6H2O → C6H12O6 + 6O2 (ΔH = +2880 kJ/mol)
Để học sinh dễ nhớ, tôi hay so sánh với việc nhận tiền – số tiền tăng lên nên mang dấu dương.
Ứng dụng trong thực tế
Hiểu về enthalpy giúp tối ưu hiệu quả phản ứng. Cách tính hiệu suất phản ứng đơn giản, bài tập hiệu suất phản ứng.
Trong công nghiệp, phản ứng tỏa nhiệt được ứng dụng sản xuất năng lượng. Phản ứng thu nhiệt dùng trong bảo quản thực phẩm.
Kiểm soát nhiệt độ phản ứng rất quan trọng. Nó ảnh hưởng trực tiếp đến hiệu suất và chất lượng sản phẩm.
FAQ: Câu hỏi thường gặp về biến thiên enthalpy
Biến thiên enthalpy là một khái niệm quan trọng trong nhiệt hóa học cơ bản. Các câu hỏi dưới đây sẽ giúp bạn hiểu rõ hơn về biến thiên enthalpy trong phản ứng.
Cách xác định dấu của ΔH
Dấu của ΔH phụ thuộc vào chiều của phản ứng hóa học. Khi phản ứng tỏa nhiệt, ΔH mang dấu âm (-).
Ngược lại, phản ứng thu nhiệt sẽ có ΔH mang dấu dương (+). Điều này giống như việc bạn đốt củi sẽ tỏa nhiệt ra môi trường.
Trong quá trình giảng dạy, tôi thường lấy ví dụ về phản ứng cháy của metan: CH4 + 2O2 → CO2 + 2H2O, ΔH = -890 kJ/mol.
Mối liên hệ giữa ΔH và nhiệt phản ứng
Nhiệt phản ứng chính là giá trị tuyệt đối của biến thiên enthalpy. Khi phản ứng tỏa nhiệt, nhiệt phản ứng bằng -ΔH.
Với phản ứng thu nhiệt, nhiệt phản ứng bằng +ΔH. Điều này ảnh hưởng trực tiếp đến hiệu suất phản ứng công thức, tính hiệu suất phản ứng hóa học.
Tôi thường giải thích cho học sinh bằng ví dụ về phản ứng tổng hợp amoniac: N2 + 3H2 ⇌ 2NH3, ΔH = -92 kJ/mol.
Các yếu tố ảnh hưởng đến ΔH
Nhiệt độ là yếu tố quan trọng nhất ảnh hưởng đến ΔH. Khi nhiệt độ tăng, giá trị ΔH thường tăng theo.
Áp suất cũng có tác động đến ΔH, đặc biệt với các phản ứng có sự thay đổi thể tích. Nồng độ chất phản ứng càng cao, ΔH càng lớn.
Chất xúc tác không làm thay đổi giá trị ΔH nhưng giúp phản ứng xảy ra nhanh hơn. Đây là kinh nghiệm tôi rút ra sau nhiều năm giảng dạy.
Việc áp dụng công thức tính biến thiên enthalpy đóng vai trò quan trọng trong nghiên cứu nhiệt động học và phản ứng hóa học. Các phương pháp tính toán đơn giản cùng với sự phân loại rõ ràng giữa phản ứng tỏa nhiệt và thu nhiệt giúp học sinh nắm vững kiến thức cơ bản. Những ứng dụng thực tiễn của enthalpy trong công nghiệp và đời sống minh chứng cho tầm quan trọng của việc tính toán chính xác giá trị ΔH trong hóa học.
Bài viết liên quan
Tổng quan công thức Faraday hóa và ứng dụng trong điện phân
Tìm hiểu chi tiết về công thức Faraday hóa học trong điện phân, cách áp dụng định luật và giải bài tập với phương pháp đơn giản. Hướng dẫn tính toán khối lượng chất điện phân chuẩn xác.

Thông tin chi tiết về công thức tỉ khối và cách áp dụng trong hóa học
Tìm hiểu công thức tỉ khối và cách áp dụng trong hóa học. Bài viết giải thích chi tiết các loại tỉ khối, phương pháp xác định và bài tập thực hành cho học sinh dễ hiểu.

Tổng quan công thức tính nồng độ đương lượng và cách áp dụng
Tìm hiểu chi tiết công thức tính nồng độ đương lượng, cách xác định đương lượng gam và giải bài tập với phương pháp đơn giản. Bao gồm công thức, ví dụ và bài tập mẫu có lời giải.
Tổng quan công thức tính số liên kết hóa trị và cách áp dụng chuẩn xác
Hướng dẫn công thức tính số liên kết hóa trị và phương pháp xác định chính xác các loại liên kết trong phân tử hữu cơ. Giải thích chi tiết cách tính liên kết σ, π kèm bài tập minh họa.
Phân tích công thức tính liên kết hidro và ứng dụng trong hóa học
Tìm hiểu công thức tính liên kết hidro và cách áp dụng trong các phân tử, gen, protein. Giải thích chi tiết bản chất, vai trò quan trọng trong nước, rượu và axit nucleic.

Công thức tính đồng phân và cách xác định nhanh các dạng đồng phân hóa học
Tìm hiểu công thức tính đồng phân và phương pháp xác định nhanh số đồng phân trong hóa học. Hướng dẫn chi tiết cách tính đồng phân ankan, ancol kèm bài tập và mẹo giải nhanh cho học sinh.

