Công thức tính số liên kết Pi và cách xác định trong hợp chất hữu cơ
Công thức tính số liên kết pi giúp xác định cấu trúc phân tử hữu cơ. Liên kết pi đóng vai trò quan trọng trong các phản ứng hóa học. Bài viết trình bày chi tiết cách tính và ứng dụng trong các nhóm hợp chất cơ bản.
Công thức tính số liên kết pi
Liên kết pi (π) là loại liên kết hóa học đặc biệt được hình thành bởi sự xen phủ các obitan p. Để tính được số liên kết pi trong một phân tử, ta cần nắm vững công thức tính số liên kết pi.
Công thức tổng quát như sau:
Số liên kết π = (Tổng số electron π)/2
Trong đó:
- Tổng số electron π = Số electron π góp từ mỗi nguyên tử
- Mỗi nguyên tử góp số electron π = Số electron hóa trị – Số liên kết σ tham gia
Ví dụ với phân tử benzen (C6H6):
- Mỗi nguyên tử C góp: 4 – 3 = 1 electron π
- Có 6 nguyên tử C nên tổng số electron π = 6
- Số liên kết π = 6/2 = 3 liên kết
Một số lưu ý khi áp dụng công thức:
- Chỉ tính electron π từ các nguyên tử có khả năng tạo liên kết π
- Cần xác định đúng số liên kết σ mỗi nguyên tử tham gia
- Kiểm tra lại kết quả bằng cách vẽ cấu trúc Lewis
Trong quá trình giảng dạy, tôi thường gợi ý học sinh hình dung liên kết π như những “cây cầu” nối các nguyên tử. Điều này giúp các em dễ hình dung và nhớ lâu hơn.
Khái niệm và vai trò của liên kết pi trong hóa học
Liên kết pi là dạng liên kết hóa học được hình thành khi các obitan p song song chồng lấp lên nhau. Đây là liên kết bổ sung cho liên kết sigma trong phân tử.
Trong cấu trúc phân tử, liên kết pi đóng vai trò quan trọng quyết định độ bền và tính chất của hợp chất. Nó tạo nên các electron phi định xứ giúp phân tử có khả năng phản ứng đặc biệt.
Theo kinh nghiệm giảng dạy của tôi, học sinh thường nhớ liên kết pi qua hình ảnh “hai tay nắm chặt”. Một tay là liên kết sigma, tay còn lại là liên kết pi tạo nên liên kết bền vững.
Số liên kết pi là gì và cách hình thành?
Số liên kết pi trong hóa học chỉ số lượng liên kết pi có trong một phân tử. Mỗi liên kết pi được tạo thành từ sự chồng lấp của hai obitan p song song.
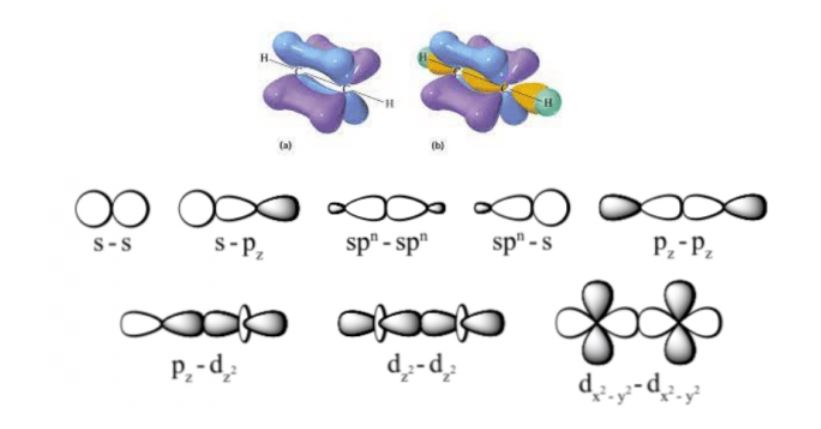
Quá trình hình thành liên kết pi diễn ra sau khi đã có liên kết sigma. Các electron trong obitan p chưa tham gia liên kết sigma sẽ chồng lấp tạo liên kết pi.
Ví dụ trong phân tử ethene (C2H4), hai nguyên tử carbon tạo một liên kết sigma và một liên kết pi. Số liên kết pi là gì trong trường hợp này? Câu trả lời là 1.
Tầm quan trọng của liên kết pi trong cấu trúc phân tử
Liên kết pi quyết định tính chất đặc trưng của nhiều hợp chất hữu cơ. Nó tạo ra các electron phi định xứ có khả năng di chuyển tự do.
Trong quá trình Enthalpy trong hóa học, liên kết pi đóng vai trò then chốt. Nó ảnh hưởng trực tiếp đến năng lượng liên kết và nhiệt phản ứng.
Các phân tử có nhiều liên kết pi thường bền vững hơn về mặt cấu trúc. Tuy nhiên chúng cũng dễ tham gia phản ứng cộng do liên kết pi yếu hơn liên kết sigma.
Phân biệt liên kết pi và liên kết sigma
Liên kết sigma được tạo thành từ sự chồng lấp trực tiếp giữa các obitan dọc theo trục liên kết. Trong khi đó liên kết pi hình thành từ sự chồng lấp bên của các obitan p.
Về độ bền, liên kết sigma bền vững hơn liên kết pi. Năng lượng liên kết sigma thường dao động từ 150-400 kJ/mol, còn liên kết pi chỉ khoảng 100-270 kJ/mol.
Liên kết sigma có dạng đối xứng trục, còn liên kết pi có dạng đối xứng mặt phẳng. Điều này khiến liên kết pi dễ bị phá vỡ hơn trong các phản ứng hóa học.
Hướng dẫn chi tiết cách tính số liên kết pi trong các hợp chất
Liên kết pi đóng vai trò quan trọng trong cấu trúc phân tử hữu cơ. Việc xác định chính xác số liên kết pi giúp dự đoán được tính chất và phản ứng của hợp chất.

Để tính được công thức tính số liên kết pi, chúng ta cần nắm vững các quy tắc cơ bản. Điều quan trọng là phải hiểu rõ bản chất của liên kết pi và mối quan hệ với Nhiệt hóa học cơ bản.
Quy tắc xác định số liên kết pi
Liên kết pi hình thành khi có sự xen phủ song song giữa các orbital p. Mỗi nguyên tử tham gia liên kết pi phải có orbital p chưa tham gia liên kết sigma.
Trong phân tử, liên kết pi thường xuất hiện ở liên kết đôi C=C, C=O, C=N và liên kết ba C≡C, C≡N. Cách tính số liên kết pi dựa trên việc đếm số liên kết bội trong phân tử.
Với mỗi liên kết đôi, ta có 1 liên kết pi. Với mỗi liên kết ba, ta có 2 liên kết pi. Đây là nguyên tắc cơ bản để xác định chính xác số liên kết pi.
Các bước tính số liên kết pi
Bước 1: Vẽ công thức cấu tạo của hợp chất cần tính
Bước 2: Xác định các liên kết đôi và liên kết ba trong phân tử
Bước 3: Tính tổng số liên kết pi theo công thức:
Số liên kết pi = (Số liên kết đôi × 1) + (Số liên kết ba × 2)
Trong quá trình giảng dạy, tôi thường nhắc học sinh kiểm tra lại kết quả bằng cách vẽ orbital để tránh nhầm lẫn giữa các loại liên kết.
Ví dụ minh họa cụ thể
Lấy ví dụ với phân tử but-1,3-dien CH2=CH-CH=CH2:
- Phân tử có 2 liên kết đôi C=C
- Mỗi liên kết đôi có 1 liên kết pi
- Vậy tổng số liên kết pi = 2 × 1 = 2
Với phân tử propin CH≡C-CH3:
- Phân tử có 1 liên kết ba C≡C
- Mỗi liên kết ba có 2 liên kết pi
- Vậy tổng số liên kết pi = 1 × 2 = 2
Việc thực hành nhiều bài tập đa dạng sẽ giúp nâng cao kỹ năng tính toán số liên kết pi chính xác.
Số liên kết pi trong các nhóm hợp chất hữu cơ quan trọng
Liên kết pi (π) đóng vai trò quan trọng trong cấu trúc phân tử hữu cơ. Nó quyết định tính chất hóa học của nhiều hợp chất.
Tôi thường ví von liên kết pi như “cầu nối” giữa các nguyên tử cacbon. Càng nhiều liên kết pi, phân tử càng bền vững.
Số liên kết pi trong anken và ankin
Số liên kết pi trong anken là 1 liên kết cho mỗi nối đôi C=C. Điều này tạo nên tính chất đặc trưng của anken.
Với ankin, mỗi liên kết ba C≡C có 2 liên kết pi. Số liên kết pi trong ankin gấp đôi so với anken cùng số cacbon.
Trong quá trình giảng dạy, tôi thường lấy ví dụ ethylen (C2H4) có 1 liên kết pi và acetylen (C2H2) có 2 liên kết pi.
Số liên kết pi trong benzen và hợp chất thơm
Số liên kết pi trong benzen là 3, phân bố đều trên vòng 6 cạnh. Cấu trúc này tạo nên tính thơm đặc trưng.
Số liên kết pi trong hợp chất thơm phụ thuộc vào số vòng benzen và nhóm thế. Mỗi vòng benzen đóng góp 3 liên kết pi.
Khi phản ứng xảy ra, năng lượng liên kết pi sẽ thay đổi và tạo ra Phản ứng tỏa nhiệt hấp nhiệt.
Số liên kết pi trong các hợp chất có nhóm chức
Nhóm cacbonyl (C=O) trong andehit và xeton có 1 liên kết pi. Đây là trung tâm phản ứng chính.
Nhóm cacboxyl (-COOH) trong axit cacboxylic cũng có 1 liên kết pi ở C=O. Nó quyết định tính axit của phân tử.
Các este và amit có số liên kết pi tương tự như nhóm cacboxyl. Điều này ảnh hưởng trực tiếp đến khả năng phản ứng.
Ứng dụng của số liên kết pi trong giải bài tập hóa học
Số liên kết pi trong phân tử đóng vai trò quan trọng khi giải các bài tập hóa học hữu cơ. Tôi thường hướng dẫn học sinh xác định số pi trước khi giải quyết các dạng bài tập về cấu trúc và phản ứng.
Công thức tính số liên kết pi giúp ta nhanh chóng xác định được số liên kết đôi và liên kết ba trong phân tử. Với kinh nghiệm 20 năm giảng dạy, tôi luôn nhấn mạnh công thức:
π = (2x + 2 – H)/2
Trong đó:
– π: số liên kết pi
– x: số nguyên tử cacbon
– H: số nguyên tử hiđro
Bài tập về xác định cấu trúc phân tử
Khi xác định cấu trúc phân tử, việc biết số liên kết pi trong hợp chất hữu cơ giúp ta dự đoán được các nhóm chức có thể có. Tôi thường gợi ý học sinh làm theo các bước:
Bước 1: Tính số π từ công thức phân tử
Bước 2: Liệt kê các khả năng phân bố π (liên kết đôi hoặc ba)
Bước 3: Kết hợp với các dữ kiện khác để chọn cấu trúc phù hợp
Ví dụ với C4H6, ta có π = (8 + 2 – 6)/2 = 2, có thể là 2 liên kết đôi hoặc 1 liên kết ba.
Bài tập về tính độ bất bão hòa
Độ bất bão hòa liên quan trực tiếp đến Biến thiên enthalpy là gì của phản ứng. Số π càng lớn, độ bất bão hòa càng cao.
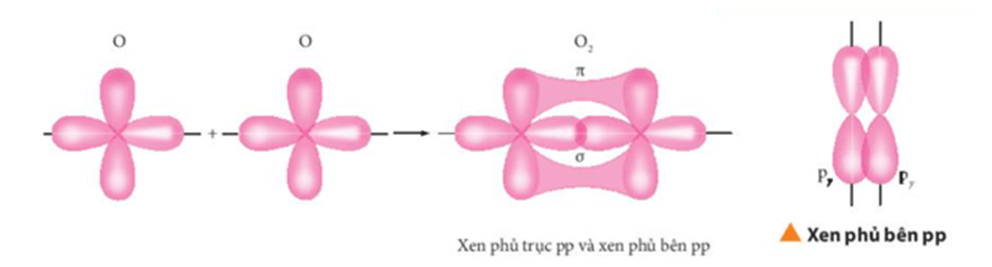
Công thức tính độ bất bão hòa:
- B = x + 1 – (H/2)
- B = π + vòng
Tôi thường cho học sinh so sánh kết quả từ hai công thức để kiểm tra chéo và tránh sai sót.
Bài tập về phản ứng cộng
Phản ứng cộng thường xảy ra ở liên kết π. Mỗi liên kết π có thể cộng với 1 phân tử H2, Br2, HBr…
Khi giải bài tập phản ứng cộng, cần:
- Xác định số π ban đầu
- Tính số mol chất cộng tối đa
- Viết phương trình phản ứng theo từng giai đoạn
Kinh nghiệm cho thấy học sinh thường quên kiểm tra số π còn lại sau mỗi phản ứng cộng.
FAQ: Câu hỏi thường gặp về số liên kết pi
Các câu hỏi thường gặp về số liên kết pi giúp làm rõ những thắc mắc phổ biến của học sinh khi học về liên kết hóa học. Tôi sẽ giải đáp chi tiết từng vấn đề để các em nắm vững kiến thức này.
Làm sao phân biệt được liên kết pi và sigma?
Liên kết pi và sigma có thể phân biệt dựa vào cách hình thành và đặc điểm orbital. Liên kết sigma tạo thành khi các orbital chồng lấp theo trục liên kết, tạo mật độ electron tập trung dọc trục.
Trong khi đó, liên kết pi hình thành do sự chồng lấp song song của các orbital p, tạo mật độ electron tập trung ở hai bên trục liên kết. Điều này khiến liên kết pi yếu hơn và dễ bị phá vỡ hơn liên kết sigma.
Tại sao benzen có 3 liên kết pi?
Benzen có cấu trúc vòng 6 cạnh với 6 nguyên tử carbon sp2. Mỗi carbon đều có 1 orbital p vuông góc với mặt phẳng vòng. Các orbital p này chồng lấp tạo thành hệ thống liên hợp pi deloc hóa.
Do có 6 electron pi được đóng góp từ 6 carbon, chúng tạo thành 3 cặp electron pi deloc hóa trên toàn vòng. Vì vậy benzen có tổng cộng 3 liên kết pi, tạo nên tính bền vững đặc trưng của hợp chất thơm.
Số liên kết pi có ảnh hưởng gì đến tính chất hóa học?
Số liên kết pi ảnh hưởng trực tiếp đến độ bền và khả năng phản ứng của phân tử. Càng nhiều liên kết pi, định nghĩa biến thiên enthalpy càng cao do năng lượng liên kết tăng.
Các phân tử có nhiều liên kết pi thường có xu hướng tham gia phản ứng cộng hơn là thế. Điều này do liên kết pi kém bền hơn liên kết sigma và dễ bị tấn công bởi các tác nhân ái điện tử.
Ngoài ra, sự có mặt của liên kết pi còn tạo ra hiệu ứng cộng hưởng, làm tăng độ bền của phân tử và ảnh hưởng đến tính chất vật lý như nhiệt độ sôi, nhiệt độ nóng chảy.
Việc nắm vững công thức tính số liên kết pi giúp học sinh dễ dàng xác định cấu trúc phân tử hữu cơ. Các quy tắc tính toán đơn giản cùng nhiều ví dụ minh họa trong các nhóm hợp chất như anken, ankin và benzen tạo nền tảng vững chắc cho việc học hóa hữu cơ. Kiến thức về liên kết pi là chìa khóa quan trọng để giải quyết các bài tập về cấu trúc phân tử và phản ứng hóa học.
Bài viết liên quan
Tổng quan công thức Faraday hóa và ứng dụng trong điện phân
Tìm hiểu chi tiết về công thức Faraday hóa học trong điện phân, cách áp dụng định luật và giải bài tập với phương pháp đơn giản. Hướng dẫn tính toán khối lượng chất điện phân chuẩn xác.

Thông tin chi tiết về công thức tỉ khối và cách áp dụng trong hóa học
Tìm hiểu công thức tỉ khối và cách áp dụng trong hóa học. Bài viết giải thích chi tiết các loại tỉ khối, phương pháp xác định và bài tập thực hành cho học sinh dễ hiểu.

Tổng quan công thức tính nồng độ đương lượng và cách áp dụng
Tìm hiểu chi tiết công thức tính nồng độ đương lượng, cách xác định đương lượng gam và giải bài tập với phương pháp đơn giản. Bao gồm công thức, ví dụ và bài tập mẫu có lời giải.
Tổng quan công thức tính số liên kết hóa trị và cách áp dụng chuẩn xác
Hướng dẫn công thức tính số liên kết hóa trị và phương pháp xác định chính xác các loại liên kết trong phân tử hữu cơ. Giải thích chi tiết cách tính liên kết σ, π kèm bài tập minh họa.
Phân tích công thức tính liên kết hidro và ứng dụng trong hóa học
Tìm hiểu công thức tính liên kết hidro và cách áp dụng trong các phân tử, gen, protein. Giải thích chi tiết bản chất, vai trò quan trọng trong nước, rượu và axit nucleic.

Công thức tính đồng phân và cách xác định nhanh các dạng đồng phân hóa học
Tìm hiểu công thức tính đồng phân và phương pháp xác định nhanh số đồng phân trong hóa học. Hướng dẫn chi tiết cách tính đồng phân ankan, ancol kèm bài tập và mẹo giải nhanh cho học sinh.

