Khám phá công thức cấu tạo HNO3, tính chất và ứng dụng
HNO3 là hợp chất hóa học có mức độ nguy hiểm cao nhưng lại được ứng dụng phổ biến trong nhiều lĩnh vực của cuộc sống. Bạn muốn hiểu rõ hơn về công thức cấu tạo HNO3 cũng như tính chất, ứng dụng của hợp chất này? Hãy cùng congthuchoahoc.com theo dõi ngay những thông tin dưới đây để có câu trả lời.
Công thức cấu tạo HNO3 là gì?
HNO3 là công thức hóa học của axit nitric hay còn gọi là dung dịch nitrat hidro. Trong tự nhiên, HNO3 được tạo thành từ những cơn mưa giông có sấm sét thường dẫn đến hiện tượng mưa axit.
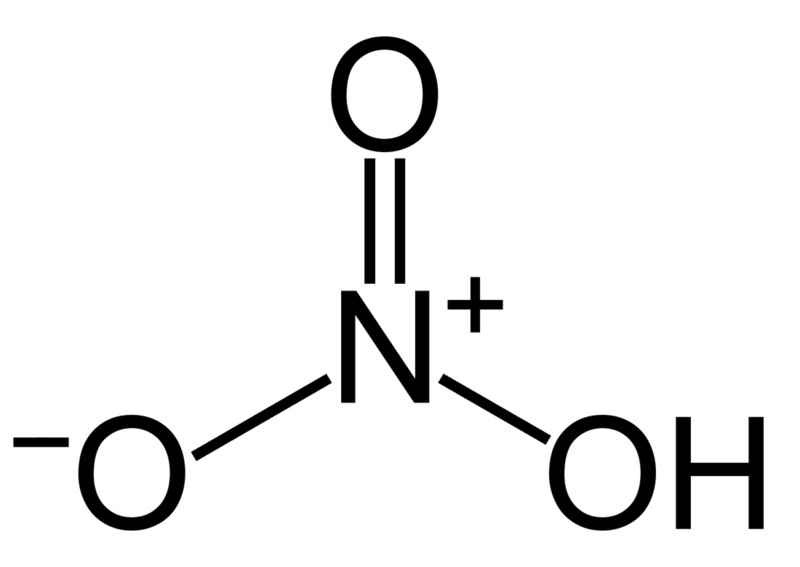
Công thức cấu tạo HN03 gồm:
- 1 nguyên tử Hydro (H)
- 1 nguyên tử Nitơ (N)
- 3 nguyên tử Oxy (O)
Tính chất vật lý của HNO3
Một số tính chất vật lý cơ bản của axit nitric:
- Màu sắc: HNO3 tồn tại ở thể lỏng hoặc thể khí và trong suốt không có màu. Trong tự nhiên, axit nitric sẽ chuyển sang màu vàng nhạt do tích tụ oxit nito.
- Độ tan: Axit nitric dễ tan trong nước với C < 65%.
- Tỷ trọng: HNO3 tinh khiết có tỷ trọng 1511 kg/m3.
- Phản ứng với môi trường: HNO3 nồng độ 86% để ngoài không khí sẽ xảy ra hiện tượng bốc khói trắng. Khi bị ánh sáng chiếu vào, HN03 phân hủy thành N02.
- Nhiệt độ sôi: Axit nitric sôi ở 83 độ C.
- Chưng cất: Axit nitric chưng cất với nước tinh khiết ở 120.5 độ C, 1atm thu được hỗn hợp có nồng độ 68% HNO3.
- Các tính chất vật lý khác: HN03 có tính ăn mòn cao, dễ cháy và rất độc dù chỉ tiếp xúc với một lượng nhỏ.
Tính chất hóa học của HNO3
HNO3 có tính chất hóa học đa dạng, tham gia vào quá trình phản ứng với nhiều hợp chất khác. Từ đó tạo ra những sản phẩm được ứng dụng phổ biến trong công nghiệp và cuộc sống. Dưới đây là những tính chất hóa học quan trọng của axit nitric:
Phản ứng điện li
HNO3 là axit mạnh có thể tan nhanh trong nước tạo ra ion nitrat NO3− và proton hydrat. Phương trình điện li của HN03 như sau:
- H3O+ HNO3 + H2O → H3O+ + NO3-
Phản ứng với bazo, oxit bazo, muối cacbonat
HNO3 là axit mạnh có thể tác dụng với bazo, oxit bazo, muối của axit yếu hơn để tạo thành muối nitrat và nước. Một số phương trình hóa học thể hiện tính axit của HNO3:
- 2HNO3 + ZnO → Zn(NO3)2 + H2O
- Mg(OH)2 + 2HNO3 +→ Mg(NO3)2 + 2H2O
- 2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
Phản ứng với kim loại
Axit nitric có tính chất ăn mòn hầu hết các kim loại để tạo thành muối nitrat, trừ Au và Pt. Ngoài ra, kim loại sắt, nhôm và crom cũng thụ động với dung dịch HNO3 đặc nguội. Phản ứng hóa học giữa HN03 đặc/ loảng và kim loại có tính khử mạnh/ yếu cũng khác nhau.
HN03 phản ứng với kim loại tính khử yếu (Cu, Ag,…) tạo thành muối, nước và NO/N02.
- Cu + 4HNO3(đ) → Cu(NO3)2 + 2NO2 + 2H2O
- 3Cu + 8HNO3(l) → 3Cu(NO3)2 + 2NO + 4H2O

HNO3 phản ứng với kim loại có tính khử mạnh (Mg, Zn, Al,…) tạo thành muối, nước và NO2/ N2O/ NH4NO3.
- Mg + 4HNO3(đ) → Mg(NO3)2 + 2NO2 + 2H2O
- 8Al + 30HNO3(l) → 8Al(NO3)3 + 3N2O + 15H2O
- 4Zn + 10HNO3 (rất loãng) → 4Zn(NO3)2 + NH4NO3 + 3H2O
Phản ứng với phi kim
HN03 tác dụng với hầu hết phi kim (trừ silic và halogen) tạo thành oxit của phi kim, NO/NO2 và nước. Ví dụ:
- C + 4HNO3(đ) → 4NO2 + 2H2O + CO2
- 3C + 4HNO3(l) → 3CO2 + 4NO + 2H2O
Phản ứng với hợp chất
Axit nitric tác dụng với một số hợp chất để tạo kết tủa, NO/ NO2 và nước. Ví dụ như:
- 3H2S + 2HNO3 (>5%) → 3S kết tủa + 2NO + 4H2O
- PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ứng dụng phổ biến của axit nitric trong cuộc sống
HNO3 có khả năng tác dụng với nhiều hợp chất hóa học nên được sử dụng làm nguyên liệu sản xuất cho nhiều lĩnh vực. Cụ thể, ứng dụng phổ biến của axit nitric như sau:
- Trong sản xuất: HNO3 được sử dụng làm nguyên liệu sản xuất phân bón, thuốc nổ, thuốc nhuộm, muối nitrat dùng trong phòng thí nghiệm,…
- Ngành xi mạ, luyện kim: Axit nitric có tính ăn mòn kim loại nên được ứng dụng phổ biến trong lĩnh vực này.
- Chất tẩy rửa: HNO3 sử dụng trong nhà máy để tẩy rửa hệ thống đường ống hoặc bề mặt kim loại.
Thuốc thử: Trong phòng thí nghiệm, HN03 được dùng làm thuốc thử phân biệt các chất hóa học. - Xử lý nước: HNO3 có thể xử lý một số tạp chất để cân bằng độ pH của nước.

Tiếp xúc với HNO3 nguy hiểm như thế nào?
HNO3 có phản ứng với các chất hữu cơ, do đó sẽ gây nguy hại cho con người và các sinh vật khác nếu như tiếp xúc trực tiếp. Một số ảnh hưởng của HNO3 tới sức khỏe con người là:
- Ảnh hưởng hệ hô hấp: Nếu hít phải HNO3 ở thể khí sẽ gây ho, ngạt mũi, hắt hơi, chảy nước mũi. Nghiêm trọng hơn, HNO3 gây khó thở, viêm phổi và dẫn đến tử vong nếu không xử lý kịp thời.
- Tác động đến hệ tiêu hóa: Nuốt phải axit nitric gây bỏng hệ tiêu hóa và ảnh hưởng tới tính mạng con người.
- Ảnh hưởng tới mắt: HN03 bắn vào mắt làm tổn thương giác mạc dẫn đến mù lòa.
- Ảnh hưởng tới da: Axit nitric tiếp xúc với da gây bỏng nặng.
Lời kết
Có thể thấy, công thức cấu tạo HN03 có sự liên kết đặc biệt giữa các nguyên tử. Nhờ cấu tạo này, HNO3 có tính chất hóa học đa dạng, đặc trưng để có thể ứng dụng phổ biến trong nhiều lĩnh vực.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

