Công thức tính tỉ khối và cách áp dụng trong các bài toán hóa học cơ bản
Công thức tính tỉ khối giúp xác định mối quan hệ về khối lượng giữa các chất. Các công thức này áp dụng cho chất khí, dung dịch và hỗn hợp. Thầy sẽ hướng dẫn chi tiết cách tính với nhiều bài tập thực hành.
Công thức tính tỉ khối và ý nghĩa trong hóa học
Tỉ khối là đại lượng so sánh khối lượng của hai chất có cùng thể tích. Đây là một khái niệm quan trọng giúp xác định mật độ tương đối giữa các chất.
Công thức tính tỉ khối được biểu diễn như sau:
d = m1/m2 = D1/D2
Trong đó:
- d: tỉ khối (không có đơn vị)
- m1, m2: khối lượng của chất 1 và chất 2 (g)
- D1, D2: khối lượng riêng của chất 1 và chất 2 (g/cm3)
Qua 20 năm giảng dạy, tôi nhận thấy học sinh thường nhầm lẫn giữa tỉ khối và khối lượng riêng. Tỉ khối không có đơn vị vì đây là tỉ số của hai đại lượng cùng loại.
Ví dụ thực tế: Tỉ khối của nước đá so với nước lỏng là 0,92. Điều này giải thích tại sao nước đá nổi trên mặt nước.
Trong công nghiệp, tỉ khối giúp kiểm tra nồng độ dung dịch axit, bazơ. Càng đậm đặc, tỉ khối càng lớn. Đây là cách đơn giản để kiểm tra chất lượng sản phẩm.
Khi giải bài tập, các em cần chú ý:
– Luôn xác định rõ chất nào là chất 1, chất nào là chất 2
– Đảm bảo hai đại lượng so sánh phải cùng đơn vị
– Kiểm tra kết quả có hợp lý không dựa vào thực tế
Tỉ khối là gì và các khái niệm cơ bản cần nắm vững
Trong hóa học, tỉ khối là đại lượng biểu thị mối quan hệ giữa khối lượng của một chất với khối lượng của một chất chuẩn có cùng thể tích. Đây là một khái niệm quan trọng giúp so sánh mật độ tương đối giữa các chất.
Để hiểu rõ hơn về tỉ khối, chúng ta cần nắm vững một số khái niệm cơ bản và mối liên hệ giữa chúng. Điều này sẽ giúp việc tính toán và ứng dụng tỉ khối trong thực tế trở nên dễ dàng hơn.
Định nghĩa và ý nghĩa của tỉ khối trong hóa học
Tỉ khối được định nghĩa là tỉ số giữa khối lượng của một thể tích chất bất kỳ với khối lượng của cùng thể tích chất chuẩn ở cùng điều kiện nhiệt độ và áp suất.
Trong giảng dạy, tôi thường ví von tỉ khối như “cân nặng tương đối” giữa các chất. Nó cho biết một chất “nặng” gấp bao nhiêu lần so với chất chuẩn.
Ý nghĩa quan trọng nhất của tỉ khối là giúp xác định nhanh khối lượng riêng của chất khi biết khối lượng riêng chất chuẩn và ngược lại.
Các đơn vị đo tỉ khối thường gặp
Tỉ khối là một đại lượng không thứ nguyên, nghĩa là không có đơn vị. Nó chỉ là một con số thuần túy.
Trong thực tế, người ta thường dùng các chất chuẩn phổ biến như:
– Nước tinh khiết ở 4°C (d = 1 g/ml)
– Không khí ở điều kiện tiêu chuẩn
– Hydro (H2) đối với khí
Khi làm thí nghiệm, tôi luôn nhắc học sinh ghi rõ chất chuẩn được sử dụng để tránh nhầm lẫn khi tính toán.
Mối liên hệ giữa tỉ khối và khối lượng riêng
Tỉ khối và khối lượng riêng có mối quan hệ mật thiết thông qua công thức:
D = ρ1/ρ2
Trong đó:
– D là tỉ khối
– ρ1 là khối lượng riêng của chất cần xác định
– ρ2 là khối lượng riêng của chất chuẩn
Kinh nghiệm của tôi cho thấy học sinh thường nhớ công thức này tốt hơn khi viết dưới dạng:
Tỉ khối = Khối lượng riêng chất/Khối lượng riêng chất chuẩn
Công thức tính tỉ khối cho các trạng thái vật chất khác nhau
Tỉ khối là đại lượng quan trọng giúp xác định mật độ tương đối giữa các chất. Việc tính tỉ khối phụ thuộc vào trạng thái của vật chất và điều kiện nhiệt độ, áp suất.

Tôi thường giảng cho học sinh rằng tỉ khối giống như “cân nặng tương đối” giữa các chất. Nó cho biết chất nào “nặng” hơn chất nào khi so sánh cùng thể tích.
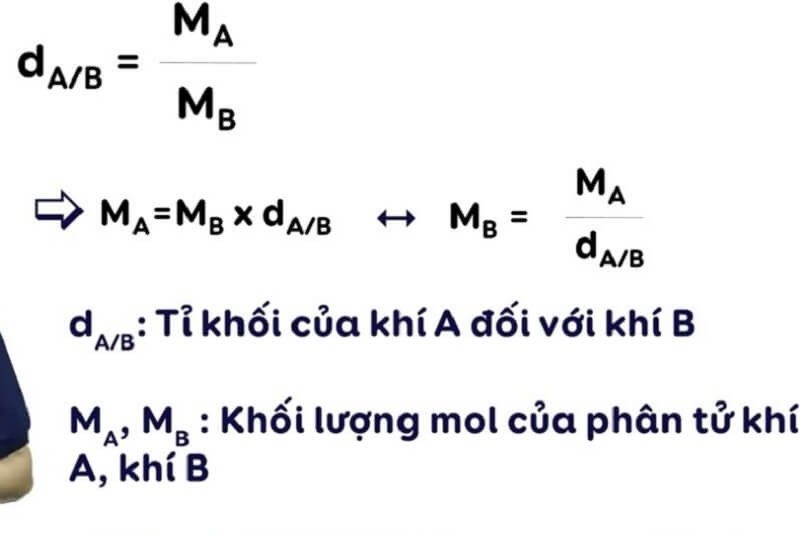
Công thức tính tỉ khối chất khí
Tỉ khối chất khí được tính bằng công thức:
d = M1/M2
Trong đó:
– d là tỉ khối của khí 1 so với khí 2
– M1 là khối lượng mol của khí 1 (g/mol)
– M2 là khối lượng mol của khí 2 (g/mol)
Qua 20 năm giảng dạy, tôi nhận thấy học sinh dễ nhớ công thức này khi liên hệ với việc so sánh “cân nặng” của 2 khí.
Công thức tính tỉ khối dung dịch
Tỉ khối dung dịch được xác định theo công thức:
d = ρdd/ρnc
Trong đó:
– d là tỉ khối của dung dịch
– ρdd là khối lượng riêng của dung dịch (g/ml)
– ρnc là khối lượng riêng của nước cất (g/ml)
Khi giải các bài tập về công thức tính nồng độ dung dịch, tỉ khối dung dịch là yếu tố quan trọng cần xác định trước.
Công thức tính tỉ khối hỗn hợp khí
Tỉ khối hỗn hợp khí được tính theo công thức:
dhh = Mhh/M2
Trong đó:
– dhh là tỉ khối của hỗn hợp khí so với khí chuẩn
– Mhh là khối lượng mol trung bình của hỗn hợp (g/mol)
– M2 là khối lượng mol của khí chuẩn (g/mol)
Khối lượng mol trung bình của hỗn hợp được tính dựa trên phần mol và khối lượng mol của từng khí thành phần.
Phương pháp tính tỉ khối hơi so với các chất chuẩn
Tỉ khối hơi là đại lượng so sánh khối lượng của một chất ở thể hơi với khối lượng của chất chuẩn. Việc tính toán chính xác tỉ khối hơi giúp xác định được nhiều tính chất quan trọng của chất.
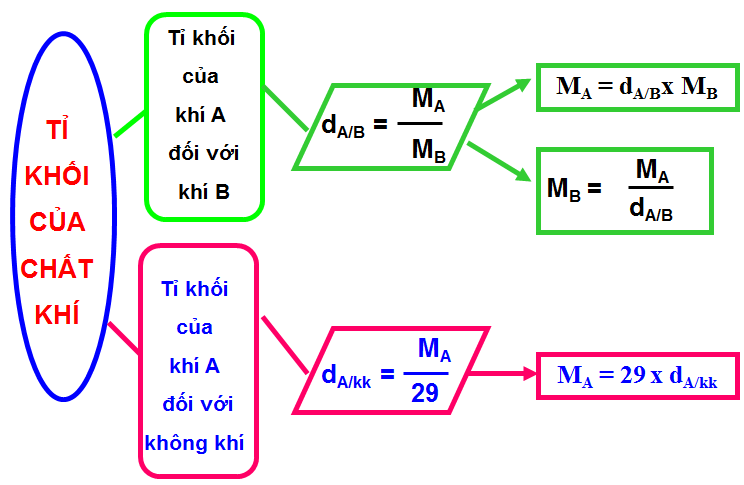
Để tính được tỉ khối hơi, trước tiên cần nắm vững công thức tính khối lượng mol. Từ đó có thể áp dụng cho các trường hợp so sánh với chất chuẩn khác nhau.
Tỉ khối hơi so với không khí
Tỉ khối hơi so với không khí được tính bằng công thức:
d(không khí) = M/29
Trong đó:
– d(không khí) là tỉ khối hơi so với không khí
– M là khối lượng mol của chất cần tính
– 29 là khối lượng mol trung bình của không khí
Ví dụ: Khí CO2 có M = 44 g/mol
Vậy d(không khí) = 44/29 = 1,52
Tỉ khối hơi so với hydro
Tỉ khối hơi so với hydro được xác định theo công thức:
d(H2) = M/2
Trong đó:
– d(H2) là tỉ khối hơi so với hydro
– M là khối lượng mol của chất cần tính
– 2 là khối lượng mol của H2
Khi giảng dạy, tôi thường nhắc học sinh ghi nhớ số 2 là khối lượng mol của H2 để tránh nhầm lẫn với các chất chuẩn khác.
Mối liên hệ giữa các loại tỉ khối hơi
Giữa các loại tỉ khối không khí tồn tại mối quan hệ:
d(H2) = 14,5 × d(không khí)
Công thức này giúp chuyển đổi qua lại giữa hai loại tỉ khối một cách nhanh chóng. Học sinh có thể áp dụng công thức để kiểm tra lại kết quả tính toán.
Trong thực tế, việc tính tỉ khối so với không khí thường được sử dụng phổ biến hơn vì không khí là chất dễ tiếp xúc trong môi trường.
Bài tập áp dụng và phương pháp giải
Để nắm vững cách tính tỉ khối, chúng ta sẽ phân tích các dạng bài tập thường gặp. Mỗi dạng bài có những đặc điểm và phương pháp giải riêng.
Bài tập về tỉ khối chất khí
Khi giải bài tập tỉ khối chất khí, ta cần xác định rõ khí chuẩn. Thông thường, khí chuẩn là không khí hoặc H2.
Ví dụ: Tính tỉ khối của khí CO2 so với không khí.
– Khối lượng phân tử CO2 = 44
– Khối lượng phân tử trung bình của không khí = 29
– d = 44/29 = 1,52
Kết quả cho thấy CO2 nặng hơn không khí 1,52 lần.
Bài tập về tỉ khối dung dịch
Với dung dịch, ta cần chú ý đến nồng độ và khối lượng riêng. Việc tính toán công thức tính phần trăm thể tích sẽ giúp xác định chính xác tỉ khối.
Một kinh nghiệm tôi thường chia sẻ với học sinh là vẽ sơ đồ phân tích thành phần dung dịch. Điều này giúp hình dung rõ mối quan hệ giữa các đại lượng.
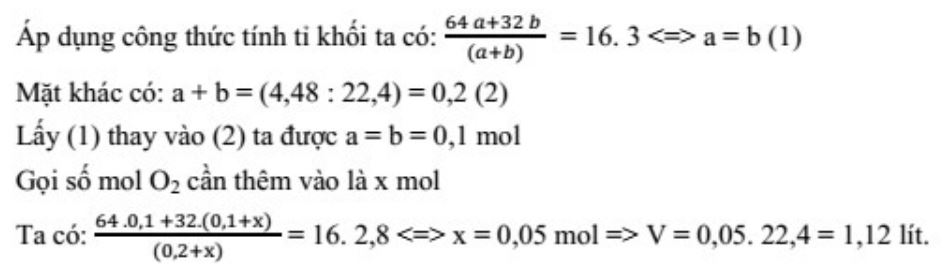
Khi giải bài tập loại này, cần ghi nhớ công thức:
d = m/V = ρ/ρnước
Bài tập về tỉ khối hỗn hợp
Với hỗn hợp nhiều chất, việc tính tỉ khối đòi hỏi phân tích kỹ thành phần. Ta cần xác định tỉ lệ các chất trong hỗn hợp.
Phương pháp giải thường theo các bước:
- Xác định khối lượng từng chất
- Tính tổng khối lượng hỗn hợp
- Tính thể tích hỗn hợp
- Áp dụng công thức tỉ khối
Một mẹo nhỏ khi giải bài tập hỗn hợp là quy đổi về cùng một đơn vị đo trước khi tính toán.
FAQ: Câu hỏi thường gặp về tỉ khối
Tỉ khối là một khái niệm quan trọng trong hóa học. Các câu hỏi dưới đây sẽ giúp bạn hiểu rõ hơn về tỉ khối và cách áp dụng.
Tại sao cần học về tỉ khối?
Tỉ khối giúp xác định mật độ tương đối của các chất so với chất chuẩn. Trong công nghiệp, tỉ khối được dùng để kiểm tra nồng độ dung dịch axit, bazơ.
Qua 20 năm giảng dạy, tôi nhận thấy học sinh nắm vững tỉ khối sẽ dễ dàng giải các bài tập về dung dịch. Đặc biệt khi làm thí nghiệm, tỉ khối giúp xác định độ tinh khiết của hóa chất.
Làm thế nào để phân biệt các loại tỉ khối?
Tỉ khối không khí là tỉ số khối lượng của chất khí so với khối lượng không khí cùng thể tích, nhiệt độ và áp suất. Công thức: D = M/29 (M là khối lượng mol).
Tỉ khối hơi là tỉ số khối lượng của chất khí so với khối lượng H2 cùng điều kiện. Công thức: D = M/2.
Tỉ khối dung dịch là tỉ số khối lượng dung dịch so với khối lượng nước cùng thể tích. Công thức: d = m1/m2.
Những sai lầm thường gặp khi tính tỉ khối
Học sinh thường nhầm lẫn giữa các loại tỉ khối khi giải bài tập. Tôi khuyên các em cần ghi nhớ đơn vị đo và điều kiện áp dụng của từng loại.
Một lỗi phổ biến khác là quên quy đổi đơn vị đo khi tính toán. Ví dụ khi tính tỉ khối dung dịch, khối lượng riêng phải cùng đơn vị g/ml hoặc kg/m3.
Ngoài ra, nhiều em bỏ qua việc kiểm tra điều kiện nhiệt độ và áp suất khi tính tỉ khối khí. Điều này dẫn đến kết quả sai lệch đáng kể.
Việc áp dụng công thức tính tỉ khối đóng vai trò quan trọng trong hóa học và đời sống. Các công thức tỉ khối giúp xác định chính xác khối lượng riêng của chất khí, dung dịch và hỗn hợp. Kiến thức về tỉ khối là nền tảng để giải quyết nhiều bài toán hóa học phức tạp. Giáo viên cần hướng dẫn học sinh nắm vững công thức cơ bản và phương pháp giải bài tập một cách có hệ thống.
Bài viết liên quan
Tổng quan công thức Faraday hóa và ứng dụng trong điện phân
Tìm hiểu chi tiết về công thức Faraday hóa học trong điện phân, cách áp dụng định luật và giải bài tập với phương pháp đơn giản. Hướng dẫn tính toán khối lượng chất điện phân chuẩn xác.

Thông tin chi tiết về công thức tỉ khối và cách áp dụng trong hóa học
Tìm hiểu công thức tỉ khối và cách áp dụng trong hóa học. Bài viết giải thích chi tiết các loại tỉ khối, phương pháp xác định và bài tập thực hành cho học sinh dễ hiểu.

Tổng quan công thức tính nồng độ đương lượng và cách áp dụng
Tìm hiểu chi tiết công thức tính nồng độ đương lượng, cách xác định đương lượng gam và giải bài tập với phương pháp đơn giản. Bao gồm công thức, ví dụ và bài tập mẫu có lời giải.
Tổng quan công thức tính số liên kết hóa trị và cách áp dụng chuẩn xác
Hướng dẫn công thức tính số liên kết hóa trị và phương pháp xác định chính xác các loại liên kết trong phân tử hữu cơ. Giải thích chi tiết cách tính liên kết σ, π kèm bài tập minh họa.
Phân tích công thức tính liên kết hidro và ứng dụng trong hóa học
Tìm hiểu công thức tính liên kết hidro và cách áp dụng trong các phân tử, gen, protein. Giải thích chi tiết bản chất, vai trò quan trọng trong nước, rượu và axit nucleic.

Công thức tính đồng phân và cách xác định nhanh các dạng đồng phân hóa học
Tìm hiểu công thức tính đồng phân và phương pháp xác định nhanh số đồng phân trong hóa học. Hướng dẫn chi tiết cách tính đồng phân ankan, ancol kèm bài tập và mẹo giải nhanh cho học sinh.

